グリア細胞
「グリア細胞 - 脳の黒衣、実は黒幕!? 鍵はカルシウムシグナル」
■背景 我々の脳は1000億個以上のニューロンと、その10倍以上ものグリア細胞から成り立っています。グリア細胞は、神経細胞の生存や発達機能発現のための脳内環境の維持と代謝的支援を行っています。グリア細胞には神経伝達速度を上げるためのミエリン鞘を作る「オリゴデンドロサイト」、中枢系の免疫担当である「ミクログリア」などがありますが、近年注目を集めているのがグリア細胞の中で最も数が多い「アストロサイト」です(図1)。星のような外見から命名されたアストロサイトは、実は細胞体からスポンジのように複雑な形の突起を伸ばして、脳の空間を満たしています。アストロサイトの役割は、神経細胞に栄養を与えたり、過剰なイオンや神経伝達物質を速やかに除去することにより、神経細胞の生存と働きを助けています。脳を有害物質から守る血液脳関門をつくっているのも、アストロサイトです。発見から100年もの間、アストロサイトをはじめとするグリア細胞は、神経細胞の働きを支える「黒衣」であると考えられてきました。神経細胞のように、活動電位を発しない、サイレントな細胞だと思われたからです。しかし近年、アストロサイトがシナプス伝達効率や局所脳血流の制御という,脳機能にとって本質的な役割も果たしていることも明らかになってきました。睡眠時に脳から有害物質を取り除くのも、アストロサイトの働きだということも分かり始めています。このようにアストロサイトは,たった一つの細胞で神経の生存環境の維持から神経伝達・脳血流の制御まで行うことができる、驚くほど多機能な細胞です。「黒衣」ではなくて、実は、脳の「黒幕」なのかもしれません。このアストロサイトが、器用に、複数の能力を適材適所で発現する仕組みを知ることは,脳機能の基本原理を理解する上で必要不可欠です。
図1:ヒトの脳は、1000億個の神経細胞と、その10倍以上の数のグリア細胞から成る。グリア細胞には、ミクログリア、オリゴデンドロサイト、アストロサイトなどの種類がある。
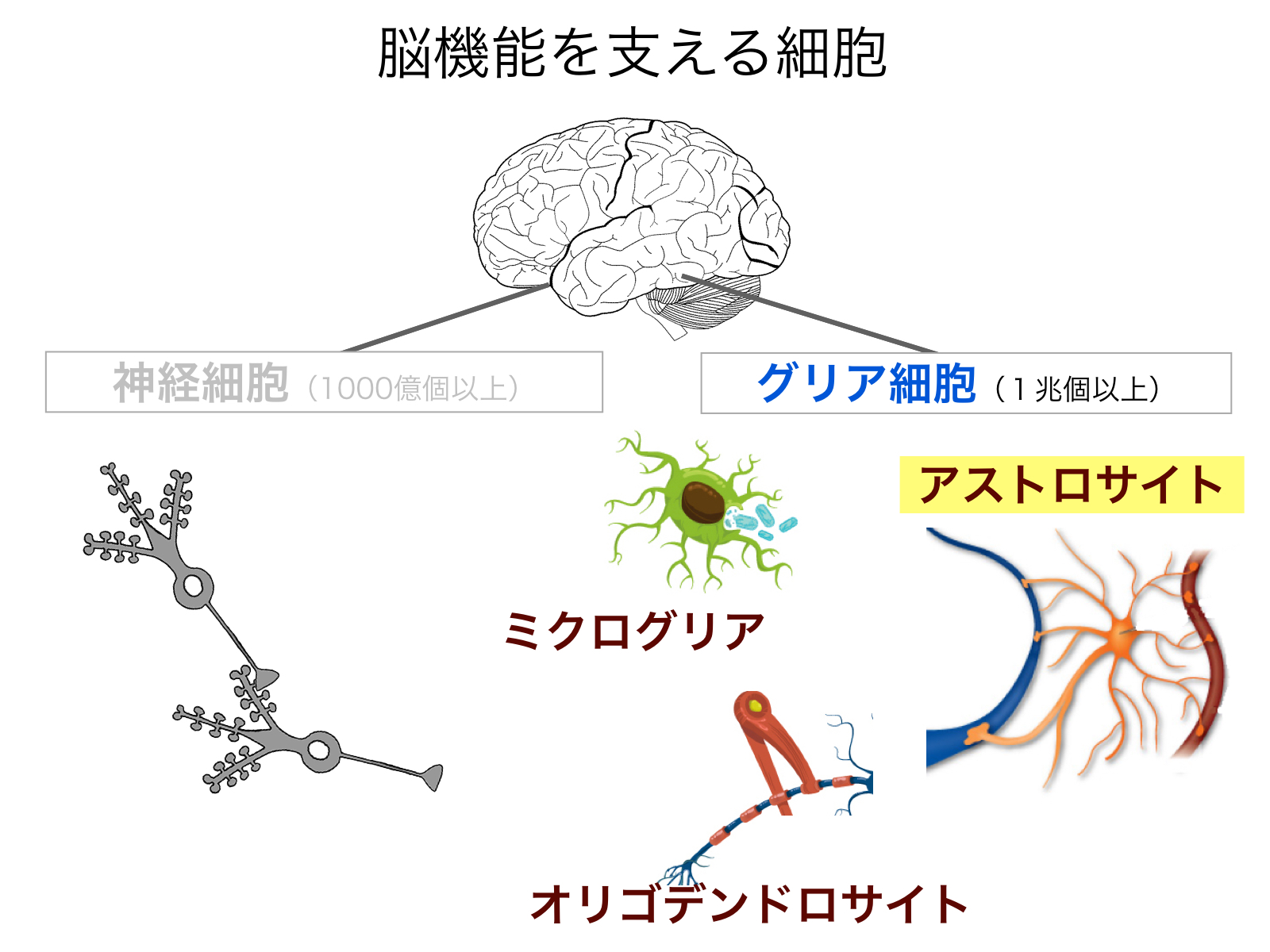
図2:カルシウムイメージングの概念図。カルシウム指示薬の蛍光強度の増減により、細胞内カルシウム濃度変化を可視化する。
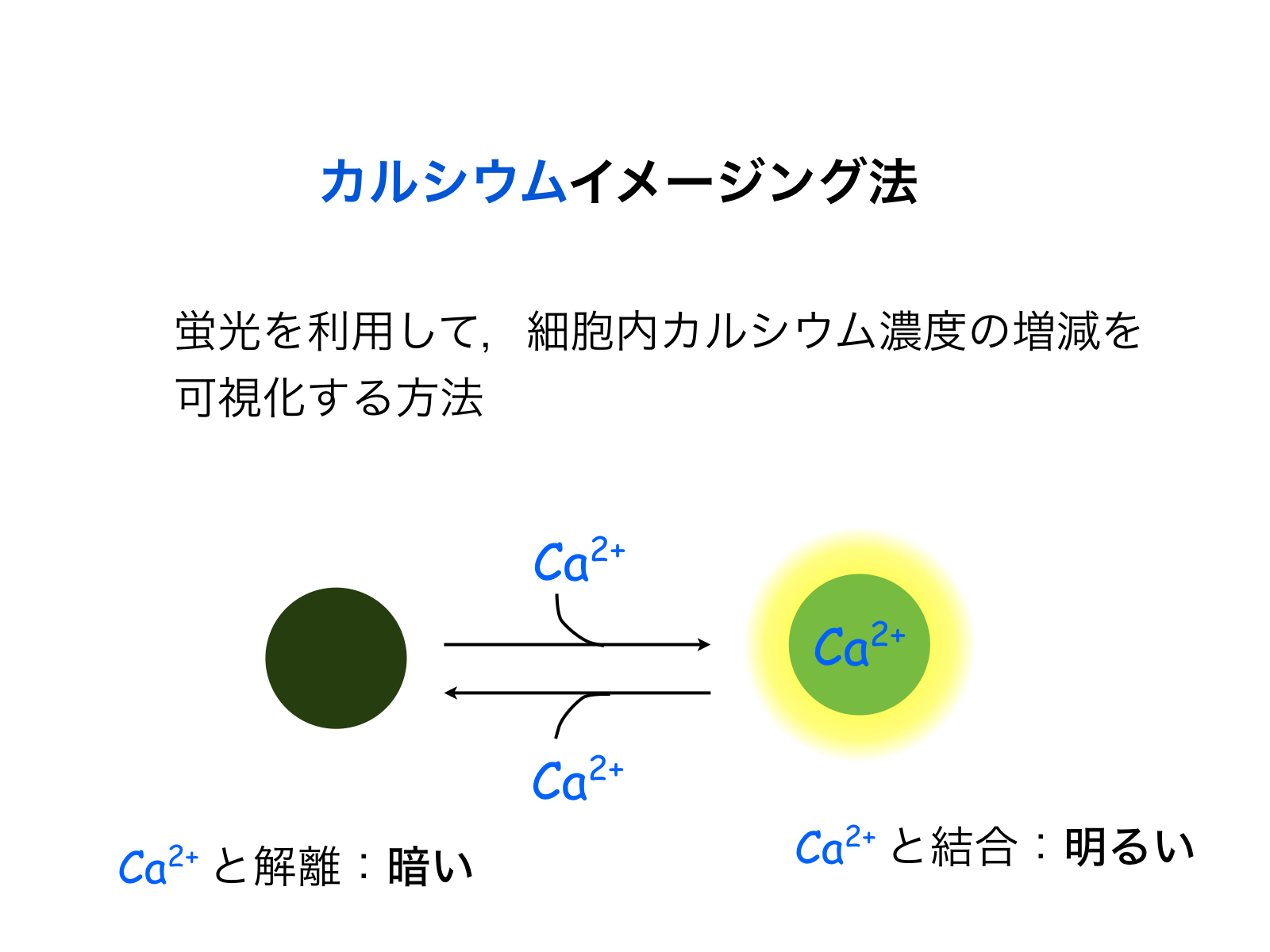
図3:アストロサイトはカルシウムシグナルを使って、シナプス伝達と脳血流を制御している。
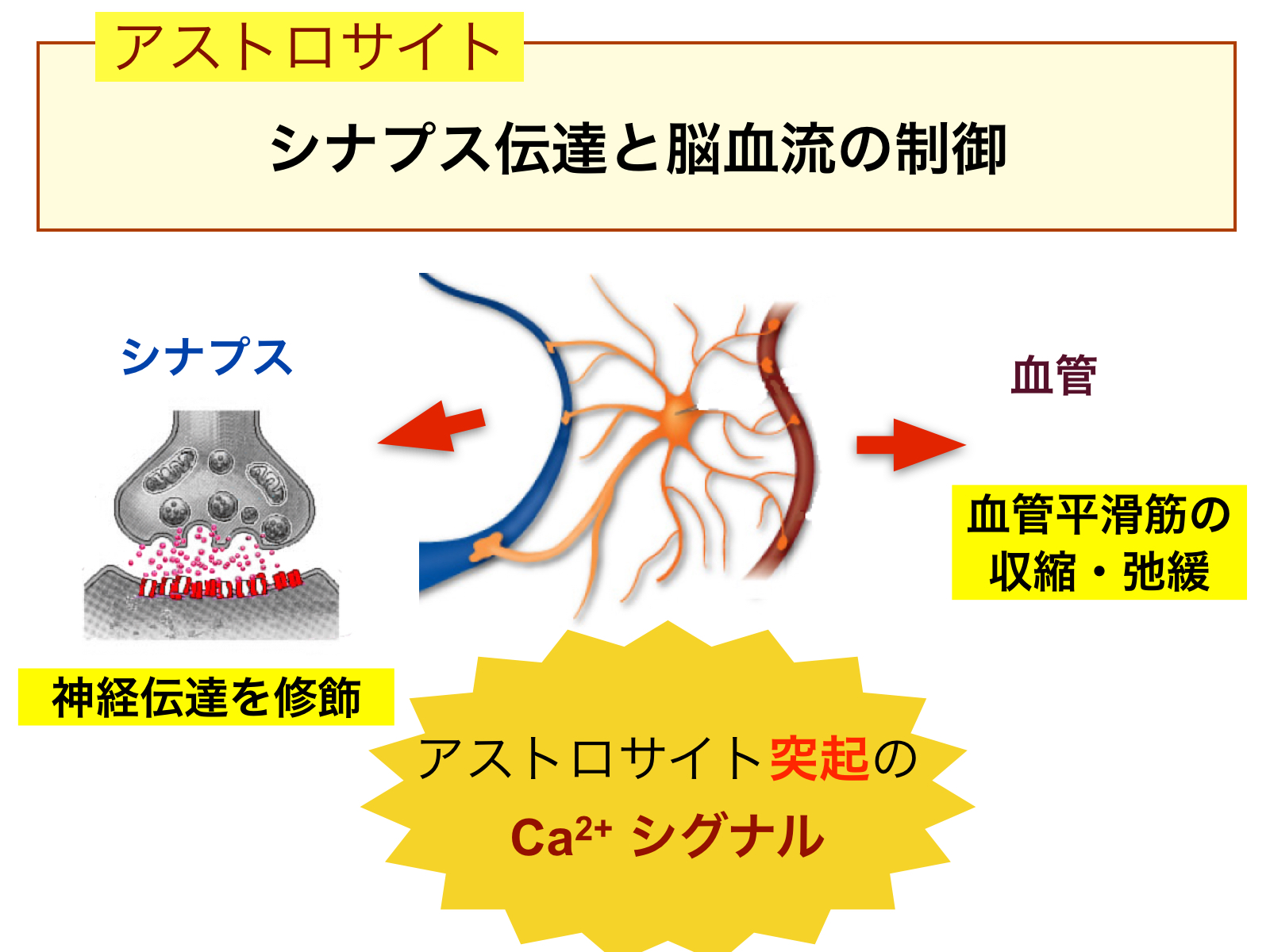
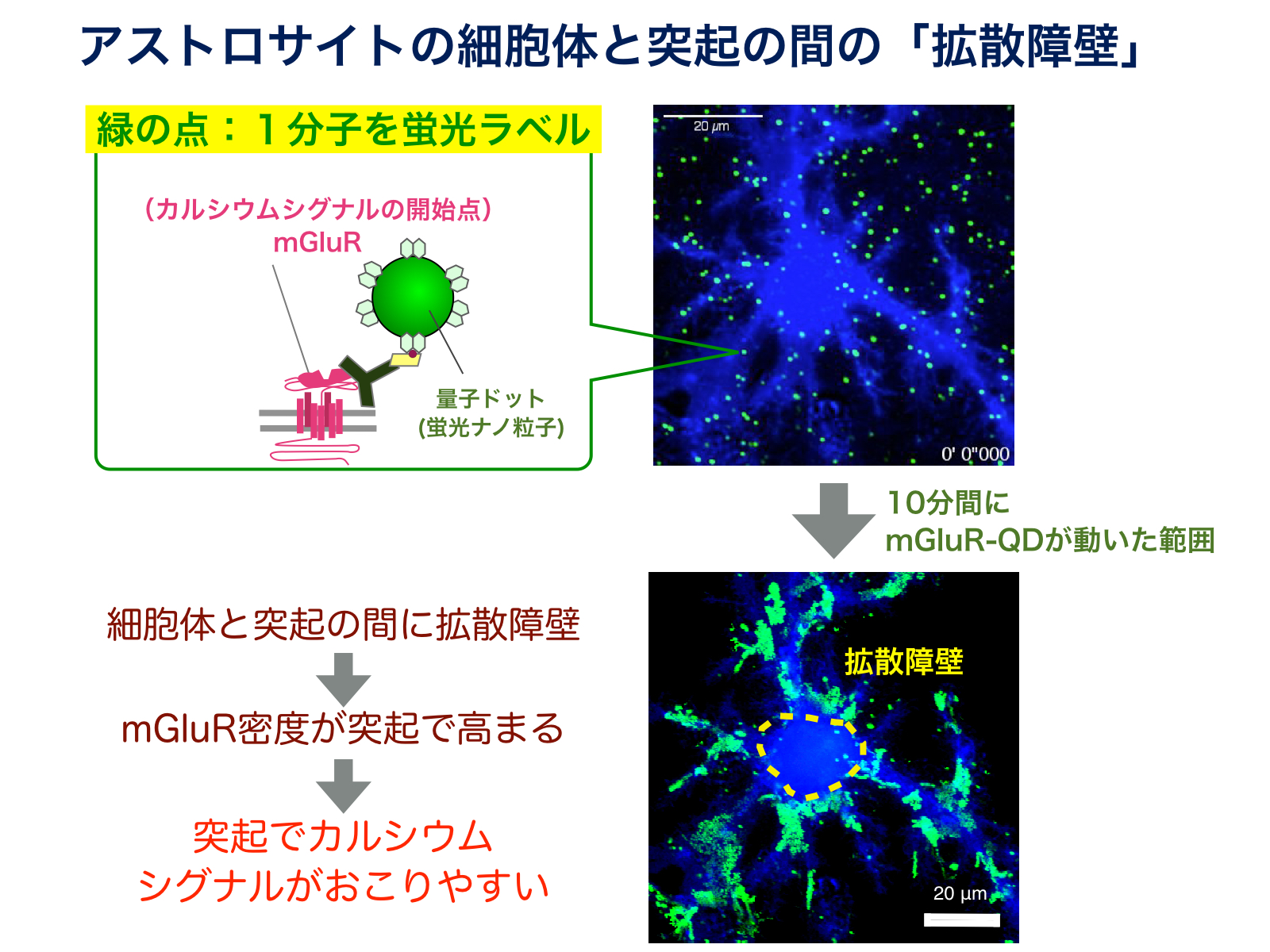
図4:1分子イメージングという手法をつかって可視化された、アストロサイトの拡散障壁。細胞体と突起とのmGluR分子の行き来ができなくなることにより、突起でmGluRの密度が高まり、カルシウムシグナルがおこりやすくなる。
■研究概要
細胞内のカルシウム濃度を可視化できる「カルシウムイメージング法(図2)」を用いてアストロサイトを観察することにより、サイレントだと思われていたアストロサイトが、細胞外のシグナルに活発に応答していることが明らかになりました。シナプス伝達効率や局所脳血流制御の引き金となるのも、細胞内カルシウム濃度の増減「カルシウムシグナル」です(図3)。カルシウムシグナルがおこると、アストロサイトから神経細胞や他の細胞へシグナル伝達物質が放出されます。アストロサイトでのカルシウムシグナルと伝達物質の放出が記憶学習との関連の有無は、現在脳科学分野で最もホットなトピックの一つとなっており、未だに結論がでていません。私たちは、このアストロサイトのカルシウムシグナルがどのようにしておこるか、アストロサイトのカルシウムシグナルがどこまで脳機能の制御に関わるかを明らかにしようとしています。
私たちは、下村脩博士(2008年ノーベル化学賞)が発見した「蛍光たんぱく質GFP」をベースにした「遺伝子コード型カルシウムセンサー」を用いて、海馬のアストロサイトのカルシウムシグナルを観察しました。すると、アストロサイトの細胞体よりも、突起でカルシウムシグナルがおこりやすいことがわかりました1)。アストロサイトの一種である小脳バーグマングリアでは、突起の一部にカルシウムシグナルがおこりやすいホットスポットが存在することも見出しました2)。
アストロサイトの突起でカルシウムがおこりやすくなっている理由を調べるために、カルシウムシグナルを引き起こすmGluRという分子の分布を免疫染色法で調べたところ、mGluRが突起部分に多く存在していることが分かりました。そこでmGluRが突起に集まった状態を維持できる仕組みを明らかにするために、mGluR分子の動きを一分子レベルでの追跡を行いました3), 4)。驚いたことに、mGluRは細胞膜上を自由に動くことはできるものの、突起と細胞体の間を移動できないことが明らかになりました(図4)。つまり突起と細胞体の間にmGluRに対する拡散障壁があったのです。アストロサイトはmGluRに対する拡散障壁を突起と細胞体の間に設けることで、mGluRが集中した状態を維持し、突起部分にCa2+シグナルを発生させやすくしていると考えられます1), 5)。
■科学的・社会的意義 近年,アストロサイトでのカルシウムシグナルの異常と,てんかんなどの脳神経疾患との関連性が指摘されています。たとえば、てんかんやアルツハイマー病などの脳疾患のアストロサイトにみられるようなカルシウムシグナルの異常は、これらの疾患の発病機序に関わっている可能性があります。今後アストロサイトと神経細胞の密接な連携を研究することによって、神経細胞の研究だけでは解けなかった脳の生理と病理に関する多くの謎が解き明かされることが期待されます。
■良く使用する機器
1)倒立型リサーチ顕微鏡 (オリンパス株式会社)
2)EMCCDカメラ ImagEM (浜松フォトニクス株式会社)
3)共焦点レーザ走査型顕微鏡,多光子励起レーザ走査型顕微鏡(オリンパス株式会社)
4)共焦点レーザ走査型顕微鏡システム(株式会社ニコンインステック)
5)画像取得・解析用ソフトウェア Metamorph(モレキュラーデバイス)
■良く使用する材料
1)実験試薬 (和光純薬工業株式会社,他)
2)ラット海馬初代培養
3)マウススライス培養
■参考文献
1)Arizono M, *Bannai H, Nakamura K, Niwa F, Enomoto M, Matsu-Ura T, Miyamoto A, Sherwood MW, Nakamura T, *Mikoshiba K. “Receptor-selective diffusion barrier enhances sensitivity of astrocytic processes to metabotropic glutamate receptor stimulation.”
Science Signaling 5: ra27. (2012)
https://stke.sciencemag.org/content/5/218/ra27
2)Tamamushi S Nakamura T, Inoue T, Ebisui E, Sugiura K, Bannai H, *Mikoshiba K.
“Type 2 inositol 1,4, 5-trisphosphate receptor is predominantly involved in agonist-induced Ca(2+) signaling in Bergmann glia. “
Neurosci Res. 74: 32-41. (2012)
https://www.sciencedirect.com/science/article/pii/S0168010212001393
3)Bannai H, Lévi S, Schweizer C, Dahan M, *Triller A. “Imaging the lateral diffusion of membrane molecules with quantum dots.”
Nature Protocols 1:2628-2634. (2006) [92, IF5y 11.296]
https://www.nature.com/nprot/journal/v1/n6/full/nprot.2006.429.html
4)Arizono M, Bannai H, *Mikoshiba K.
“Imaging mGluR5 Dynamics in Astrocytes Using Quantum Dots.”
Curr Protoc Neurosci. 66:2.21.1-2.21.18. (2014)
https://onlinelibrary.wiley.com/doi/10.1002/0471142301.ns0221s66/abstract
5)有薗 美沙, 坂内 博子, 丹羽 史尋, 御子柴 克彦
「アストロサイトの活動を仕切る拡散障壁」
生物物理 Vol. 53 (2013) No. 2 通巻306号 p. 105-106
https://www.jstage.jst.go.jp/article/biophys/53/2/53_105/_article/-char/ja/
 H28年度分野別専門委員
H28年度分野別専門委員
科学技術振興機構 さきがけ専任研究員
理化学研究所 脳科学総合研究センター
坂内 博子
https://hamhamqdspt.strikingly.com/
「神経系の脇役だけではない、主役にもなるグリア細胞」
■背景 神経系を構成する細胞は、神経細胞(ニューロン)とグリア細胞に大別されます。ニューロンは、細かく枝分かれした樹状突起と細く長い軸索を持ち、樹状突起で受け取った情報を処理して軸索を用いて伝達し出力します。それに対し、グリア細胞は、ニューロンの活動をサポートしていると考えられてきました。中枢神経系(主に脳及び脊髄)と末梢神経系(内臓や皮膚に突起を伸ばす神経)で、異なる種類のグリア細胞が存在しています。以下に、その名称と主な特徴を述べます。
| [中枢神経系] | |
| アストロサイト:ニューロンが放出したイオンや神経伝達物質を取り込んで脳内環境を保持する他、ニューロンの生存に必要な神経栄養因子を合成し分泌する。また、グリコーゲンを貯蔵し、エネルギー源としてニューロンに供給する。血管内皮とともに血液脳関門を形成し、血液中の物質の内、脳に取り入れる物を選択する。 上衣細胞:アストロサイトに似た役割。脳室表面に細胞体を持つ。 オリゴデンドロサイト:軸索を巻く髄鞘(ミエリン)を形成する。 ミクログリア:異常代謝物などのゴミを取り込み、分解する。 |
|
| [末梢神経系] | |
| シュワン細胞:軸索を巻く髄鞘(ミエリン)を形成する。 サテライト細胞:神経節に存在し、神経細胞の細胞体を取り巻く。 |
|
近年、生物学に物理学的知識や技術を導入する生物物理学の力によって、脳神経機能の測定技術が急速に進化しました。その結果、グリア細胞は、上述の機能に加えて、ダイナミックに情報を交換したり、ニューロンの機能を制御するなど、主体的な役割も果たしていることが明らかになってきました。以下では、一例として、筆者らが見出したグリア細胞による体液ナトリウム濃度センシングと、神経活動制御について、簡単にご紹介します。
■研究概要
砂漠などで水を飲めない状況が続くと、体液の水分が失われます。血液の主要成分は塩化ナトリウム(NaCl)であり、脱水状態では体液Na濃度が高まります。この時、動物は塩を避けようとします。このように、体液のNa状態をモニタリングしているのは、脳の脳室周囲器官と呼ばれる部位にあるグリア細胞(アストロサイト及び上衣細胞)であることがわかりました(文献1–3)。そのセンサーは、グリア細胞に発現しているチャネル分子Naxでした(文献2、4)。Naxは脱水により体液Na濃度が上昇すると開口し、Naイオンが選択的に細胞内へ流入します(図1)。また、NaxはNaKポンプと結合しており、NaイオンをNaKポンプに供給して活性化します。その結果、NaKポンプにATPを供給するための嫌気的糖代謝系が活性化し、副産物として乳酸が産生されます。この乳酸が隣接するニューロンに供給され、神経活動が高まる。この一連の仕組みが明らかになりました(文献5、6)。また、Naxに対する抗体が体内で産生された結果、自己免疫疾患によって高Na血症になった患者が見つかりました(文献7、8)。
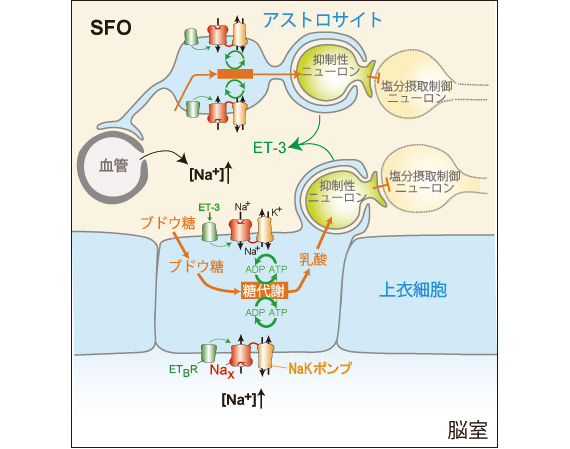
図1 体液(血液・脳脊髄液)Na濃度センシング機構。ET-3(エンドセリン3)は受容体ETBRに結合してNaxの感度を調節している。脱水時には、抑制性ニューロンによって塩分摂取行動を指令するニューロンの活動が抑えられるために、塩の摂取量が落ちると考えられる。(文献5より改変引用)
■科学的・社会的意義 本研究は、体液を感知して行動を制御する仕組みを明らかにした初めての例であると同時に、グリア細胞がセンシングを行い、その感知した情報に基づいて神経活動を制御することが明らかになった初めての例です。脳室周囲器官は血液脳関門が無く、血液成分のモニタリングに適した部位ですが、この領域のアストロサイトや上衣細胞はニューロンの回りを巻く特殊な形態をもつことがわかっています(文献3)。今後、様々な体液成分のセンシングにおけるグリア細胞の役割が明らかになっていくものと考えています。
■参考文献
1)Hiyama TY, Watanabe E, Okado H, Noda M. (2004) “The subfornical organ is the primary locus of sodium-level sensing by Nax sodium channels for the control of salt-intake behavior” J. Neurosci. 24: 9276–9281.
2)檜山武史, 野田昌晴 (2005). “脳内ナトリウムセンサーNax” 生物物理45: 247–252.
3)Watanabe, E., Hiyama, T.Y., Shimizu, H., et al. (2006). “Sodium-level-sensitive sodium channel Nax is expressed in glial laminate processes in the sensory circumventricular organs” Am J. Physiol. 290: R568–576.
4)Hiyama, T.Y., Watanabe, E., Ono, K., et al. (2002). “Nax channel involved in CNS sodium-level sensing” Nature Neurosci. 5: 511–512.
5)Shimizu, H., Watanabe, E., Hiyama, T.Y. et al. (2007). “Glial Nax channels control lactate signaling to neurons for brain [Na+] sensing” Neuron 54: 59–72.
6)檜山武史, 野田昌晴 (2007). “脳における体液Naレベル感知機構 グリア細胞が神経活動を制御するしくみの解明” 実験医学 25: 2538–2541.
7)Hiyama, T.Y., Matsuda, S., Fujikawa, A., et al. (2010). “Autoimmunity to the sodium-level sensor in the brain causes essential hypernatremia” Neuron 66: 508–522.
8)檜山武史, 野田昌晴 (2010). “Naxに対する自己抗体の産生が本態性高Na血症の原因となる” 細胞工学 29: 1132–1138.
■良く使用する材料・機器
1)蛍光指示薬(同仁化学研究所、和光純薬株式会社、サーモフィッシャーサイエンティフィック株式会社)
2)蛍光顕微鏡システム(株式会社オリンパス、株式会社ニコンインステック)
3)高速共焦点顕微鏡装置(横河電機株式会社)
4)冷却CCDカメラ(浜松ホトニクス株式会社、アンドール・テクノロジーLtd)
5)光刺激装置製作の光学部品(株式会社ニコンインステック、株式会社オプトライン)
6)電気生理学用解析装置(モレキュラーデバイス ジャパン株式会社、株式会社インターメディカル)
 H27年度分野別専門委員
H27年度分野別専門委員
基礎生物学研究所・統合神経生物学研究部門
檜山武史 (ひやまたけし)
https://niwww3.nibb.ac.jp/
