生体膜の静的・動的構造
「細胞膜分子の相互作用を1分子ごと手に取るように観察する」
■背景 生体膜は、脂質2重層に膜たんぱく質が浮かんだ2次元液体であり、受容体を介して外界と情報のやり取りの場を提供しています。近年、情報伝達の場として脂質ラフトという概念(図1)が注目されていますが、構造や役割はほとんど明らかになっていませんでした。
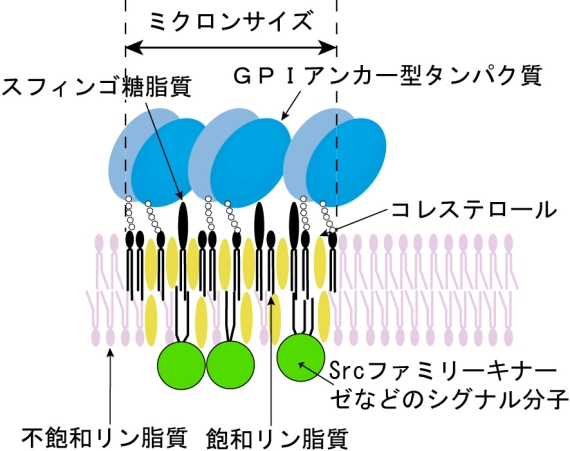
図1 提案された当初のラフトの概念図
ラフトは、ミクロンサイズと大きく、多くの分子を集めている。GPIアンカー型受容体、スフィンゴ糖脂質(ガングリオシド)、コレステロール、脂質アンカー型シグナル分子などが主な構成成分とされている。
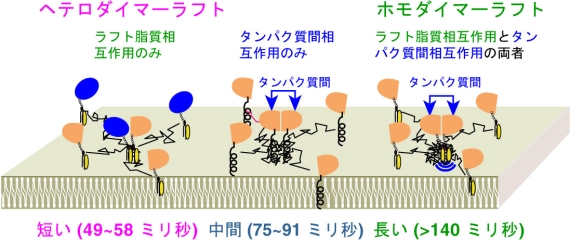
図2 GPIアンカー型受容体を含む短寿命ラフト形成
GPIアンカー型受容体のホモダイマーは、タンパク質相互作用により形成され、ラフト脂質相互作用により安定化される。
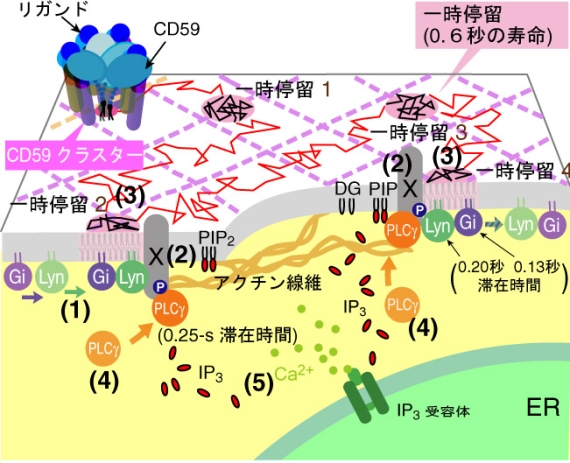
図3 CD59オリゴマーラフトによるシグナル伝達の素過程
シグナルにより受容体CD59が会合すると、安定なラフト(オリゴマーラフト)ができる。このオリゴマーラフトは膜上を動き回り、アクチン線維上で一時停留時に下流のシグナル伝達のプラットフォームとしてはたらく。
■研究概要 この疑問に答えるため、ラフトマーカーである、GPI(グリコシルホスファチジルイノシトール)アンカー型受容体や糖脂質の1分子ずつの挙動を追跡しています。これまでに定常状態において、ミクロンサイズの大きなラフトは存在せず、GPIアンカー型受容体のホモダイマーからなる非常に小さく短寿命(~200ミリ秒)のラフトが形成されていることがわかりました(図2、文献1,2)。また、受容体を刺激後には、非常に安定な受容体オリゴマーラフトがタンパク質相互作用とラフト相互作用により形成され、下流のシグナル分子を数百ミリ秒という短い期間、活性化することが判明しました(図3、文献3,4)。また、ラフト中のシグナル分子のパルス状(デイジタル式)の活性化は、細胞全体のシグナル強度を微調整(チューニング)するのに最適であると提案しています。
■科学的・社会的意義 ラフトの実態を解明することにより、ラフトが関連すると言われている疾病(アルツハイマー病やBSEなど)の発症機構の研究にも役立つと期待されます。
■参考文献
1)Suzuki, K.G.N. et al. (2012). "Transient GPI-anchored protein homodimers are units for raft organization and function" Nature Chem. Biol. 8(9): 774-783.
2)Tanaka, K.A.K* and Suzuki, K.G.N*, et al. (*equal contribution) (2010). "Membrne molecules mobile even after chemical fixation" Nature Methods 7(11): 865-866.
3)Suzuki, K.G.N. et al., (2007) “GPI-anchored receptor clusters transiently recruit Lyn and G alpha for temporary cluster immobilization and Lyn activation: single-molecule tracking study 1.” J. Cell Biol. 177(4): 717-730.
4)Suzuki, K.G.N. et al., (2007) “Dynamic recruitment of phospholipase C gamma at transiently immobilized GPI-anchored receptor clusters induces IP3-Ca2+ signaling: single-molecule tracking study 2.” J. Cell Biol. 177(4): 731-742.
■良く使用する材料・機器
1) 全反射顕微鏡システム(株式会社ニコンあるいはオリンパス)
2) EB-CCDカメラ (浜松ホトニクス株式会社)
3)ハイスピードカメラ(株式会社フォトロン)
 H24年度分野別専門委員
H24年度分野別専門委員
京都大学・物質-細胞統合システム拠点
鈴木健一(すずきけんいち)
https://www.nig.icems.kyoto-u.ac.jp/suzuki-j/homu.html
