タンパク質の構造・物性
「ふつうの蛋白質を作るには」
■背景
鉛筆、スプーン、椅子・・私たちが日々の暮らしの中で使う道具は使いやすく、長い間多くの人たちが使ってきて今の形に落ち着いた、洗練されたデザインになっています。その道具で書けること、食べられること、座れることはふつうのことですが、ちょっとした書きやすさ、持ちやすさ、座り心地の違いがその道具を長く使う上では重要であったりします。そのため、ふつうのものをちょっといいものにするデザインが探求されています(文献1)。以下では蛋白質の構造や物性について考えていきますが、これは椅子に例えれば座るための形状や丈夫さなどに当たります。
生体内で働く蛋白質の構造や機能の仕組みの研究が進展し、近年は蛋白質を作る技術も成熟して、蛋白質を工場で製造し、薬や材料として使おうという流れも強まってきました。蛋白質を使うもの、と考えた時、そもそも備わっている蛋白質のふつうさ、そしてちょっといいふつうの蛋白質とは何でしょうか。
通常、人間が製品を作るときには設計図があります。しかし、蛋白質自身は設計図を持っていません。それでも役割を果たせるように、分子進化の結果、構造や物性、機能が洗練されてきました。蛋白質がふつうにこなしているものの、特に人間に真似・再現することが難しいのは
・構造を形成すること(ただし、変性もし得る)
・溶けること(ただし、凝集もし得る)
・特定の分子と結合すること(ただし、他の分子との結合も起こり得る)
です。「(ただし、・・)」とあるのは、必ずしも自然界の蛋白質がこれらを完璧にこなしているわけではなく、常に変性や凝集、他の分子との相互作用してしまう可能性もあるからです。これらがうまくいけば蛋白質はちょっといいふつうになれるはずです。
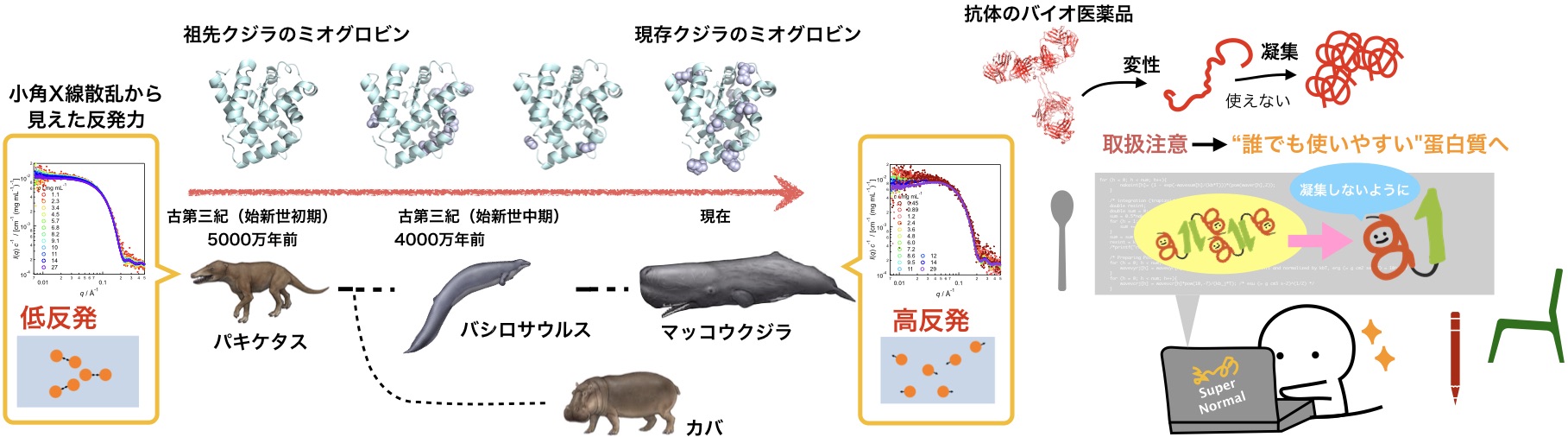
図1. クジラのミオグロビン蛋白質の分子進化に学ぶ(動物のイラストは川崎悟司氏提供)
■研究概要
例えば、人工的に設計された蛋白質と自然界に存在する蛋白質を比較すると、構造は同じでも人工設計蛋白質の方が凝集しやすい(蛋白質同士でくっつきやすい)ことが分かっています(文献2)。現在の最先端の人工設計法でも凝集を防ぐ方法論は確立されていません。一方で、自然界の蛋白質はちゃんと溶けることが出来、何らかの戦略で凝集を回避しているはずです。
この謎を解く鍵になりそうなのが、クジラなどの水棲哺乳類の進化です(図1)。もともとは陸に棲んでいたクジラ(パキケタス, ~5000万年前)は、進化とともに浅瀬に(バシロサウルス, 4000~3400万年前)、さらに深海へと高い潜水能力を獲得していきました。潜水で問題になるのが酸素不足ですが、クジラはミオグロビンという酸素を貯蔵する蛋白質を大量に筋肉中に持つことで、潜水できるようになりました。クジラの肉がブタの肉よりも濃い赤い色をしているのはそのためです(赤い色はミオグロビンです)。先祖クジラ(パキケタスやバシロサウルス時代)のミオグロビンのアミノ酸配列を推定すると、現在のマッコウクジラのミオグロビンには見られないアミノ酸残基があることがわかりました(文献3)。そして、これらを実際に作って、その物性を調べてみると確かに凝集しにくい性質を持っていることがわかりました。特筆すべきは、ミオグロビン表面の荷電アミノ酸残基の変異と構造の安定性の変化です。蛋白質が正の電荷を持ちやすいように、また、構造が壊れにくいように進化していることがわかりました。さらに分子進化と物性の変化の起源の関係を明らかにしていくことが今後の課題です。
■科学的・社会的意義
蛋白質は立体構造を保ってこそ機能を発揮することができます。しかし、しばしば変性や凝集によって機能が失われます。このことは、抗体など蛋白質を主成分とするバイオ医薬品において重要な問題です(文献4)。医薬品蛋白質の変性や凝集は薬効の低下だけでなく、免疫反応の惹起が懸念されるためです。また、製造ラインでの凝集はコストの増加・薬価の上昇につながり、そのメカニズムの解明も求められます(文献5)
蛋白質は温度が上がると変性・凝集しやすいため、冷蔵保管が必要です。気液界面でも変性・凝集しやすいので、蛋白質溶液の入った容器をガシャガシャ振ってはいけません。これらが蛋白質を“取扱注意”の使いにくいものとしています。しかし、それらを気にしなくてもいいようにすれば、蛋白質はもっと生活に身近なものになるはずです。クジラのミオグロビンの進化などの蛋白質の知見に基づいた変性や凝集を回避するデザインを探求することが、“誰でも使いやすい”蛋白質を作ることにつながるでしょう。
■参考文献
1)深澤直人, (2020) "ふつう" D&DEPARTMENT.
2)Imamura, H., Isogai, Y., Kato, M., (2012) “Differences in the structural stability and cooperativity between monomeric variants of natural and de novo Cro proteins revealed by high-pressure Fourier transform infrared spectroscopy.” Biochemistry 51: 3539-3546. https://doi.org/10.1021/bi2019223
3)Isogai, Y. Imamura, H., Nakae, S., Sumi, T., Takahashi, K., Nakagawa, T., Tsuneshige, A., Shirai, T. (2018) “Tracing whale myoglobin evolution by resurrecting ancient proteins.” Scientific Reports 8: 16883. https://doi.org/10.1038/s41598-018-34984-6
4)津本浩平, 石井明子, 内山進, 本田真也, (2022) "品質評価のカギをにぎる バイオ医薬品の分析法 知っておきたい基礎×一歩進んだ応用", じほう.
5)今村比呂志, 本田真也, (2019) “抗体の凝集メカニズム:スモルコフスキー凝集速度式によるモデリング.” 生物物理 59: 147-150. https://doi.org/10.2142/biophys.59.147
■良く使用する材料・機器
1) 赤外、紫外可視、蛍光、円偏光二色性分光装置 (日本分光株式会社)
2) 実験試薬 (和光純薬株式会社、ナカライテスク株式会社、渡辺化学工業株式会社)
3) 小角X線散乱装置 (放射光施設Photon Factory)
4) ゲルろ過カラム、逆相カラム (東ソー株式会社)
5) 液体クロマトグラフィー装置 (島津製作所)
6) pH分析機器 (堀場製作所)
 2023年分野別専門委員
2023年分野別専門委員
長浜バイオ大学・バイオサイエンス学部
今村比呂志 (いまむらひろし)
https://researchmap.jp/7000020443?lang=ja
「タンパク質を究める」
■背景
この世界に存在する物質の中で、「タンパク質」ほど素晴らしい物質は存在しないのではないでしょうか? タンパク質は、単なる物質なのに、まるで生きているかのように動き、様々な物質に結合したり、様々な物質を作り出したりすることができます。生物の中には、このようなタンパク質が無数に存在し、ダイナミックに動いています。私たちが動いたり、考えたりすることができるのは、タンパク質のおかげです。生命体の生き生きとした動きの原動力は、単なる物質であるタンパク質の生きているかのような動きなのです。
それでは、単なる物質であるタンパク質は、一体どのようにして、生きているかのように動くことができるのでしょうか? こうした疑問に答えるためには、タンパク質の基本的な性質を、物理学的な観点から理解することが必要です。このような研究が、タンパク質の物性研究です。
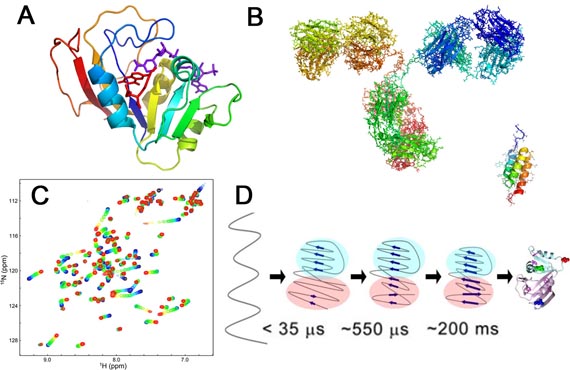
図1 A,B: タンパク質の立体構造の模式図。(A) ジヒドロ葉酸還元酵素、(B) 抗体(左)と抗体結合タンパク質(右)。C: 核磁気共鳴(NMR)装置で測定したタンパク質のNMRスペクトル。D: タンパク質のフォールディング反応機構の例(ジヒドロ葉酸還元酵素)。
■研究概要
タンパク質の物理的な性質を理解するためには、手段を選ばず、ありとあらゆる手法を駆使して研究を行います。生化学、分子生物学、物理化学、熱力学、統計力学、バイオインフォマティクスなどを総動員します。まず、遺伝子組み換え技術やタンパク質工学技術によって、研究対象のタンパク質を作成し、高純度精製します。次に、得られたタンパク質試料を徹底的に研究します。例えば、タンパク質の立体構造、変性、フォールディング、安定性、ダイナミクス、標的分子との結合反応、酵素反応などを詳細に調べます。用いる実験手法は、核磁気共鳴(NMR)法、X線結晶構造解析、X線溶液散乱法、速度論・緩和法(ストップトフロー法)、分光(蛍光)測定、熱測定などです。また、分子動力学シミュレーションなどの理論的研究も行います。実験と理論から得られたデータを詳細に解析し、タンパク質構造の時間的・空間的変化を、状態、エネルギー、相互作用といった観点から記述し、メカニズムを解明します。可能ならば、ピコ秒(10-12秒)までの時間分解能と、0.1 nm(10-10 m)までの空間分解能でタンパク質の動きを解明することに挑戦します。以上のような研究を通して、タンパク質を究めることを目指しています。
よく研究されているタンパク質としては、形状で分類すると、球状タンパク質や天然変性タンパク質などがあります。また、機能で分類すると、結合タンパク質、酵素、モータータンパク質などがあります。
■科学的・社会的意義
タンパク質は、生命体の中のあらゆる場所で働いているので、病気にも密接に関係しています。タンパク質の構造や物性を明らかにすることは、病気の発症機構を解明するだけでなく、病気を治す方法を開発する上でも非常に重要です。例えば、狂牛病、アルツハイマー病、パーキンソン病などの神経変性疾患や、食物アレルギーなどは、タンパク質の物性と密接に関係しています。また、最近では、抗体などのタンパク質を薬として用いたタンパク質医薬品が次々と実用化されており、次世代型医薬品として期待されています。
タンパク質は様々な物質を作ったり分解したりすることもできるので、食品加工や物質生産など、様々な産業にも利用されています。特に、現在期待されているのがバイオエネルギー生産です。軽油に相当するアルカンを合成するタンパク質(酵素)を使って、シアノバクテリアなどの植物内で大量のアルカンを作り出すことができれば、エネルギー問題の解決の一助になるかもしれません。しかも、このような植物は、燃料を燃やして発生した二酸化炭素を使って再びアルカンを作ることができるので、二酸化炭素量の増加も防げます。
さらに、タンパク質を設計する技術も進展しており、21世紀のうちに、医療や産業に役立つタンパク質を計算機上で自由自在に設計し、実際に使えるような時代が来ると期待されています。もしそれが可能になったら、私たちの生活は一変するでしょう。このようなタンパク質の設計技術は、生命科学の時代と呼ばれる21世紀の最大の偉業の一つとして語り継がれるかもしれません。
■参考文献
1)新井宗仁(2013)「タンパク質の揺らぎと機能 ~結合と触媒~」『揺らぎ・ダイナミクスと生体機能 ~物理化学的視点から見た生体分子~』(寺嶋正秀 編)第17章 pp.267-280, 化学同人(ISBN-10: 9784759815108)
2)Arai, M., Ferreon, J.C., & Wright, P.E. (2012) "Quantitative analysis of multisite protein ligand interactions by NMR: binding of intrinsically disordered p53 transactivation subdomains with the TAZ2 domain of CBP." J. Am. Chem. Soc. 134(8): 3792-3803.
3)Arai, M., Iwakura, M., Matthews, C.R., & Bilsel, O. (2011) "Microsecond subdomain folding in dihydrofolate reductase." J. Mol. Biol. 410(2): 329-342.
4)Arai, M., & Kuwajima, K. (2000) "Role of the molten globule state in protein folding." Adv. Protein Chem. 53: 209-282.
■良く使用する材料・機器
1) 核磁気共鳴(NMR)装置(ブルカー・バイオスピン株式会社)
2) 円二色性分散計(日本分光株式会社)
3) ガスクロマトグラフ質量分析計(株式会社島津製作所)
4) PCクラスタ(HPCシステムズ株式会社 )
5) 大腸菌(株式会社ニッポン・ジーン、株式会社バイオダイナミクス研究所など)
6) 実験試薬(ナカライテスク株式会社、和光純薬工業など)
 H26年度分野別専門委員
H26年度分野別専門委員
東京大学 大学院総合文化研究科 広域科学専攻
新井 宗仁 (あらい むねひと)
https://folding.c.u-tokyo.ac.jp/
