安定性
「タンパク質の形を保つ仕組み」
■背景 タンパク質の形(構造)は、それを構成するアミノ酸の並び順(配列)にしたがって出来上がります。しかし構造を形成することができるアミノ酸配列はごく一部に限られており、アミノ酸配列から構造を正確に予測することやアミノ酸配列情報でタンパク質をデザインすることも、現在のところ難しい問題です。そんなタンパク質の形も何らかの物理法則に支配されているはずです。タンパク質の形を保つためにどんな物理法則が潜んでいるのでしょうか?
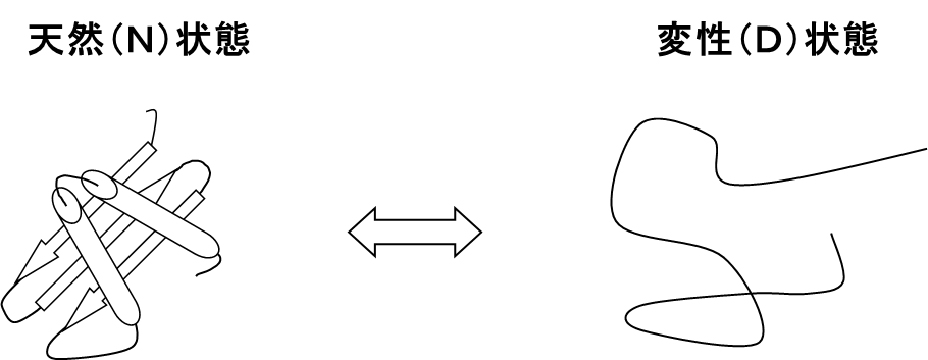
図1 タンパク質の天然(N)状態と変性(D)状態。
■研究概要
タンパク質は高温、極端なpHなどの厳しい条件下では、その形は変化し崩れます。その結果、タンパク質はその機能を失います。この現象を「変性」と呼んでいます。タンパク質の変性には、熱変性、酸・アルカリ変性、変性剤変性、低温変性、圧力変性などが知られています。変性したタンパク質を再び元の状態に戻すと、自発的に元の構造に戻り、機能も回復します。このようにタンパク質の変性は可逆的であり、形を作っている状態を天然(N)状態、形が壊れている状態を変性(D)状態とすると、図1のような関係になります。そうするとタンパク質の形を保つ力を熱力学的な量的尺度であるギブスエネルギー変化(ΔG)というもので表され、これをタンパク質の「安定性」と呼んでいます。
N ⇔ D (1)
K=[D]/[N] (2)
△G=-RTlnK (3)
ここで、[D]と[N]はそれぞれの状態の濃度、Rは気体定数、Tは絶対温度です。生理的条件下におけるタンパク質の安定性(△G)は、一般的には10kcal/mol程度で、いくらかの非共有結合のエネルギーほどになります。このことは、天然構造を形成する108個の分子に対し、1個の分子が変性構造を形成していることを表しており、生理的条件下と言っても、タンパク質のごく一部の分子が変性構造を形成している平衡状態であることを意味しています。
タンパク質の安定性の測定には、熱変性や変性剤変性を円二色性(CD)や蛍光などの分光学的手法により追跡し(図2)、得られる変性曲線を解析する方法や、断熱型示差走査熱量計(DSC)を用いて熱変性における熱量変化から変性の熱力学量を求める方法があります。分光学的手法は簡便であり、DSCではより厳密な安定性を測定することが可能です。
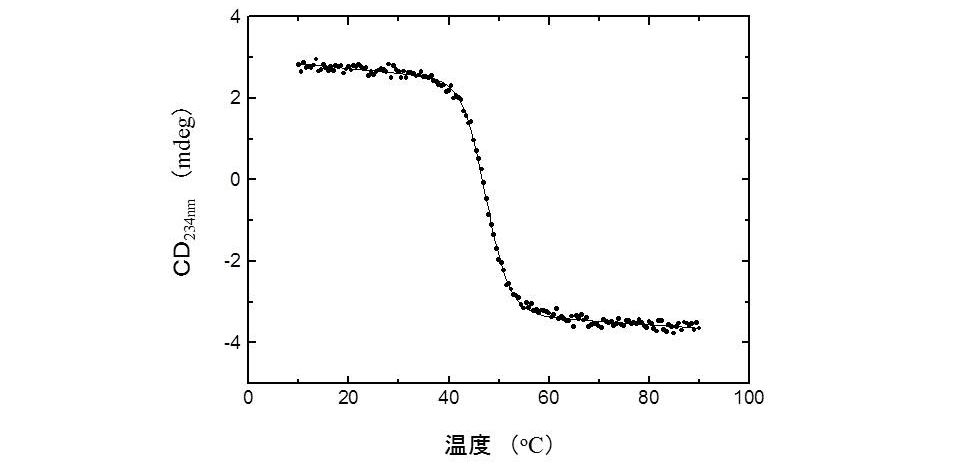
図2 タンパク質の熱変性曲線
タンパク質の構造は、非共有結合による相互作用によって安定化されています。その安定化の因子としては、疎水性相互作用、水素結合、イオン結合・静電的相互作用、水和(水分子)、構造エントロピー(Pro残基、SS結合)、金属イオンなどが考えられます。これらの因子が安定化に寄与しているかどうかは、変異タンパク質を用いて調べられ実証されてきました。例えば、分子内部のIle残基を疎水性度の低いAlaに置換した変異体(メチル基が3つ減少)の安定性は低下し不安定化します。つまり、分子内部の疎水性基がタンパク質の安定化に寄与していることがわかります(文献1)。このようにして上記のような安定化因子が特定されてきました。では、これらの安定化因子はそれぞれどの程度の大きさで安定化に寄与しているのでしょうか? これも変異タンパク質の安定性測定とさらにその立体構造を決定することで調べられてきました。水素結合の数や分子内部に埋め込まれている疎水性原子の表面積など変異による構造の変化を定量化し、変異による安定性変化と関連付けることで、それぞれの安定化因子の寄与の大きさが定量的に求められます。その結果、例えば、分子内部の炭素原子(メチル基)は1~2kcal/mol、水素結合は1~2kcal/mol、イオン結合は2~3kcal/mol安定化に寄与していることがわかります(文献2)。したがってタンパク質の構造は、これら様々な安定化因子の寄与が積み重なり、大きな不安定化効果である構造形成に伴うエントロピー損失に僅かに打ち勝つことで成り立っています。このような複雑な安定化機構が、タンパク質がそのアミノ酸配列からどのような形を作るのかを理解するのを困難にさせています。現在では、タンパク質の形作りとその安定化機構の関係を明らかにする研究が進められています(文献3)。
■科学的・社会的意義 最近、アミロイドやアルツハイマー病、プリオン病をはじめとする多くの病気で見られるタンパク質の凝集体であるアミロイド線維が、本来機能的な構造を形成しているタンパク質が主に規則的なβ構造に変化して形成されることが明らかとなってきました。様々なタンパク質についてのこれまでの研究から、環境の変化(pH、温度、濃度など)やアミノ酸変異などの要因による天然状態の「不安定化」などが原因と考えられています(文献4)。このように、タンパク質の安定性は今日問題となっている病気の発症とも深く関わっています。
■参考文献
1)Takano K, Yamagata Y, Yutani K. (1998) A general rule for the relationship between hydrophobic effect and conformational stability of a protein: stability and structure of a series of hydrophobic mutants of human lysozyme. J Mol Biol. 280, 749-761.
2)Funahashi J, Takano K, Yutani K. (2001) Are the parameters of various stabilization factors estimated from mutant human lysozymes compatible with other proteins? Protein Eng. 14, 127-134.
3)Tadokoro T, Kazama H, Koga Y, Takano K, Kanaya S. (2013) Investigating the structural dependence of protein stabilization by amino acid substitution. Biochemistry, 52, 2839-2847.
4)Ohnishi S, Takano K. (2003) Amyloidfibrils from the viewpoint of protein folding. Cell. Mol. Life Sci. 61, 511-524.
■良く使用する材料・機器
1)円二色性分散計(CD: Circular Dichroism)(日本分光株式会社)
2)分光蛍光光度計(株式会社日立ハイテクサイエンス)
 H28年度分野別専門委員
H28年度分野別専門委員
京都府立大学・大学院生命環境科学研究科
高野和文 (たかのかずふみ)
「蛋白質のかたちの安定性」
■背景
生命現象に第一義的役割をもつ蛋白質の機能発現には、それぞれ特有の姿かたち(専門用語では立体構造という)が必須である。生命とは蛋白質の多様な立体構造のハーモニによって営まれている有機体である。そのため立体構造がどのような機構で安定に維持されているかを理解することは蛋白質科学の基本的課題である。
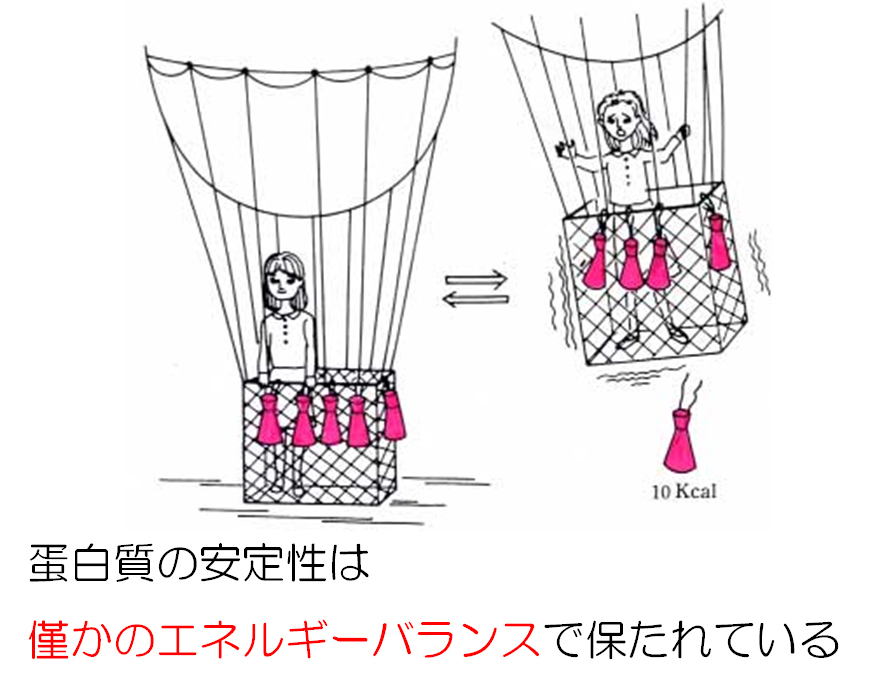
蛋白質の立体構造は、高い温度や高い濃度の変性剤に曝されると図1に示すように、らせん構造やシート構造が破壊されて、機能を失う。この立体構造の壊れる現象を変性と呼ぶ。変性蛋白質では、天然状態で分子内部に埋もれていた残基(図1ではピンクのひし形)が、溶媒に露出する。しかし、温度の低下などにより変性条件が取り除かれると元の天然状態の構造に復元し、機能も回復する。つまり、蛋白質の変性は協同的で可逆的である。式で書くと、天然(N)構造 <=> 変性(D)構造となり、その平衡定数(K)は K = [D]/[N]となる。K値が分かると、立体構造を維持しているエネルギーが算出できる。室温付近において、一般の球状蛋白質の変性構造の存在率は天然構造の1億分の1程度で、天然構造側に大きく平衡が偏っている。非常に大きく偏っているようにみえるが、エネルギーに換算すると高々10 kcal/mol程度である。このエネルギー値は蛋白質の多くの安定化因子の数モル程度(例えば水素結合の数本分)に相当するものである。蛋白質には、構造を壊そうとする大きな不安定化エネルギーと大きな安定化エネルギーが働いている。図2に示すように、蛋白質の姿かたちは、大きな不安定化エネルギーをわずかに上回る安定化エネルギーによって維持されているのである。つまり僅かのエネルギーバランス(marginal stability)で保たれている。
図1
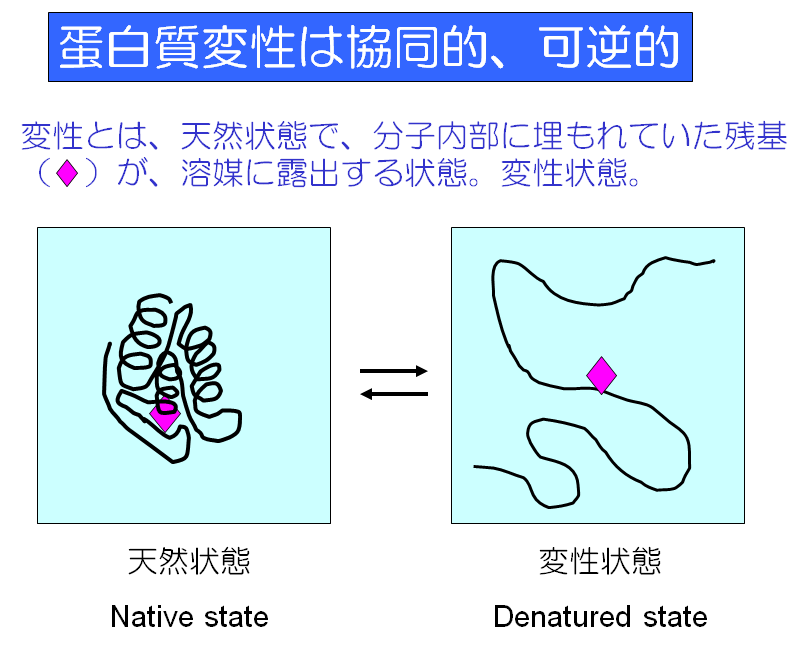
図2
■研究概要
蛋白質立体構造の安定化機構の研究は、初期の頃は常温生物由来の蛋白質の中でも精製が容易な蛋白質を用いて行われていた。常温生物が生育不可能な高温を好んで生育する好熱菌、超好熱菌が発見された20世紀終わりころから、好熱生物由来の蛋白質の安定性研究がすすめられた。好熱菌蛋白質は常温生物由来の同じ機能を持つ蛋白質との比較において高い熱安定性を示すため、安定性研究にとっては有利であった。これまでに実測された蛋白質の最高の熱変性温度は150℃である。また、「蛋白質の安定性がわずかのエネルギーバランスで保たれている」ことは、たった一残基置換させた変異型蛋白質の安定性が野生型に比べ大きく変化することからも容易に理解できる。
分子生物学の進歩によって、望み通りにアミノ酸置換した変異型蛋白質の生産が容易になった。結晶化やX線結晶構造解析技術の進展は、蛋白質立体構造の解析を容易にした。その結果、系統的で網羅的なアミノ酸変異型蛋白質を用いて、配列上の特定位置のアミノ酸残基の役割から、安定化機構を詳細に説明できるようになった。しかし、熱安定性の向上を意図した蛋白質の設計は、色々な方針が提案されているものの、設計指針通りには成功していないのが現状である。
なぜ、成功確率の高い設計指針を提案できないのか? その主な理由は次の点にある。先に述べたように蛋白質は、N状態とD状態との間で平衡にある。安定化のギブスエネルギー(ΔG)は、N状態とD状態とのエネルギーレベル間の差である。天然構造とアミノ酸置換変異型のN状態の立体構造の比較から、アミノ酸置換がもたらす構造変化は原子レべルで説明が可能である。しかし、D状態の構造は、元の構造は勿論のこと、変異がD状態にどのように影響するかも解析できていない。したがって、アミノ酸変化によるD状態の構造変化は推定すらできない。ΔGを正確に求めるには、NとD状態の構造を詳細に把握することが重要である。水中で平衡にあるD状態の構造は古くに推定されていたランダム構造ではなく、モルテングロビュール状態に近い幾つかの構造のアンサンブルであることが最近知られている。アミノ酸置換によりN状態の構造とともにD状態の構造変化が安定化エネルギー算出の重要な要であるが、D状態の構造変化データの欠けていることが予測確率の高い安定性設計を妨げている原因と言える。N状態と平衡にあるD状態の構造解析の研究が遅れているのは、生理的条件下での存在確率が先に述べたように異常に低いことと同時にD状態の構造解析技術が確立していないことが原因である。
■科学的・社会的意義 蛋白質は生命体にとって最も重要な物質の一つであるので、その立体構造がどのような機構で維持されているかを明らかにすることは、学問的に重要な基本的課題に解答を与えるとともに、アミノ酸配列から立体構造を予測するルールを発見するためにも大きな貢献をするものである。また、望みの安定性を持つ蛋白質の設計指針が確立され、蛋白質安定性を精度高くコントロールすることが出来れば、目的用途に適した安定性と機能を持つ蛋白質の創生が可能となり、基礎科学のみならず様々な応用分野(薬学、医学、農学、工学)への多大な波及効果が期待される。
■参考文献
1) Recovery of the Intact Structure of Taka-amylase A after Reduction of All Disulfide Linkages in 8M Urea. T. Isemura, T. Takagi, Y. Maeda, and K. Yutani. J. Biochem., 53, 155-161 (1963)
2) Effect of a Single Amino Acid Substitution on Stability of Conformation of a Protein. K. Yutani, K. Ogasahara, Yoshinobu Sugino & Aizo Matsusiro. Nature, 267, 274-275 (1977)
3) The Dependence of Conformational Stability on the Hydrophobicity of the Amino Acid Residue in a Series of Variant Proteins Substituted at a Unique Position of the Tryptophan Synthase -Subunit. K. Yutani, K. Ogasahara, T. Tsujita, & Y. Sugino. Proc. Natl. Acad. Sci., USA, 84, 4441-4444 (1987)
4) The unusually slow relaxation kinetics of the folding-unfolding of pyrrolidone carboxyl peptidase from a hyperthermophile, Pyrococcus furiosus. J. K. Kaushik, K. Ogasahara, & K. Yutani. J. Mol. Biol. 316, 991-1003 (2002)
5) Hyper-thermostability of CutA1 protein, with a denaturation temperature of nearly 150 oC. T. Tanaka, M. Sawano, K. Ogasahara, Y. Sakaguchi, B. Bagautdinov, E. Katoh, C. Kuroishi, A. Shinkai, S. Yokoyama, & K. Yutani. FEBS Letters, 580, 4224-4230 (2006)
6) Role of charged residues in stabilization of Pyrococcus horikoshii CutA1, which has a denaturation temperature of nearly 150oC. Y. Matsuura, M. Takehira, M. Sawano, K. Ogasahara, T. Tanaka, H. Yamamoto, N. Kunishima, E. Katoh, & K. Yutani. FEBS Journal, 279, 78-90 (2012)
7) Structural Characterization of a Trapped Folding Intermediate of Pyrrolidone Carboxyl Peptidase from a Hyperthermophile. M. Mizuguchi, M. Takeuchi, S. Ohki, Y. Nabeshima, T. Kouno, T. Aizawa, M. Demura, K. Kawano, & K. Yutani. Biochemistry, 51, 6089–6096 (2012)
■良く使用する材料・機器
1) 示差走査熱量計(DSC: Differential Scanning Calorimeter) (スペクトリス株式会社マルバーン事業部 MicroCal製,ティー・エイ・インスツルメント・ジャパン株式会社)
2) 円偏光二色性分光器(CD: Circular Dichroism) (日本分光株式会社)
 H26年度分野別専門委員
H26年度分野別専門委員
理化学研究所 RIKEN Spring-8 Center
油谷 克英(ゆたに かつひで)
