筋収縮・制御分子機構
「家族性心筋症が引き起こされる分子メカニズム」
■背景
私たちの心臓は常に拍動していますが,これには多くのタンパク質が関わっています. 心臓を構成する筋肉は心筋と呼ばれ(図1), 心筋はサルコメアという収縮の最小単位が集まってできています.サルコメアは主に,細いフィラメント(タンパク質であるF-アクチン,トロポミオシン,トロポニンの複合体)と太いフィラメント(主にミオシンタンパク質)から構成されています.トロポニンは3つの部分TnC, TnI, TnTが合体したもので,トロポミオシンに結合し, トロポミオシンは繊維状のF-アクチンに巻きついています.心筋の収縮は, 心筋細胞内のカルシウムイオン(Ca2+)濃度の変化で制御されています. 心筋が弛緩している時(図1の-Ca2+状態)は,フィラメント間には何も起きませんが,細胞内のCa2+濃度が増大しTnCにCa2+が結合すると(図1の+Ca2+状態), 細いフィラメントの構造が変化し,太いフィラメント上のミオシンがF-アクチンに結合できるようになります.F-アクチンに結合したミオシンはATPというエネルギー物質の加水分解を利用して力を発生し,心筋の収縮が起こります.その後,ミオシンがF-アクチンから離れると共に,Ca2+が回収され弛緩状態に戻ります.つまり,細いフィラメントはCa2+を利用して収縮を制御する役割をしています.
ところが,心筋のタンパク質を構成する材料であるアミノ酸に点突然変異(本来のアミノ酸が1個, 別のアミノ酸に変わること)などが起きると,この制御機構や力発生機構に何らかの異常が生じ,家族性心筋症と呼ばれる重篤な疾患を引き起こすことが知られています(文献1, 2).例えば,家族性肥大型心筋症を引き起こす変異の1つであるトロポニンT (TnT)のE244DやK247Rと呼ばれる変異を持つ細いフィラメントを含む心筋では,発生する張力が, 正常な心筋よりも大きくなってしまいます(図2). その結果,最終的には左心室の肥大が起こることで心臓が収縮しにくくなり,動悸やめまい,さらには突然死といった重篤な症状が出ることがあります.この場合の疾患の原因は,トロポニンの変異,そしてそれがもたらす心筋の発生張力の増大にあると考えられますが,どのような仕組みでこのような張力の異常な増大が起こるのでしょうか?
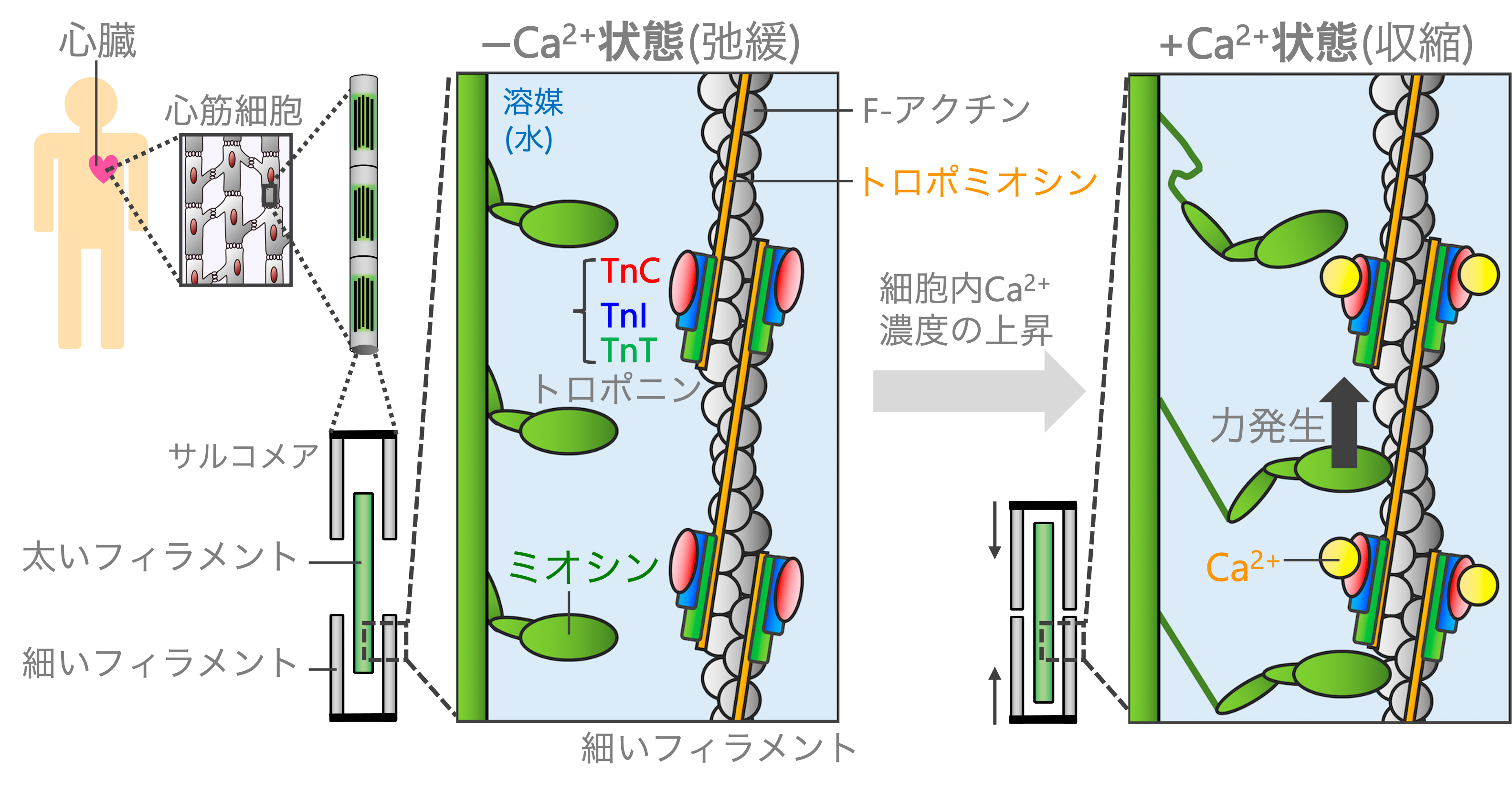
図1. 心筋(心臓を構成する筋肉)が収縮するしくみの模式図. 心筋細胞内のカルシウムイオン(Ca2+)濃度が収縮のスイッチとして働く.特に,トロポニンへのCa2+結合が収縮開始の引き金となる.実際のサルコメアは,数多くの細い・太いフィラメントを含む.
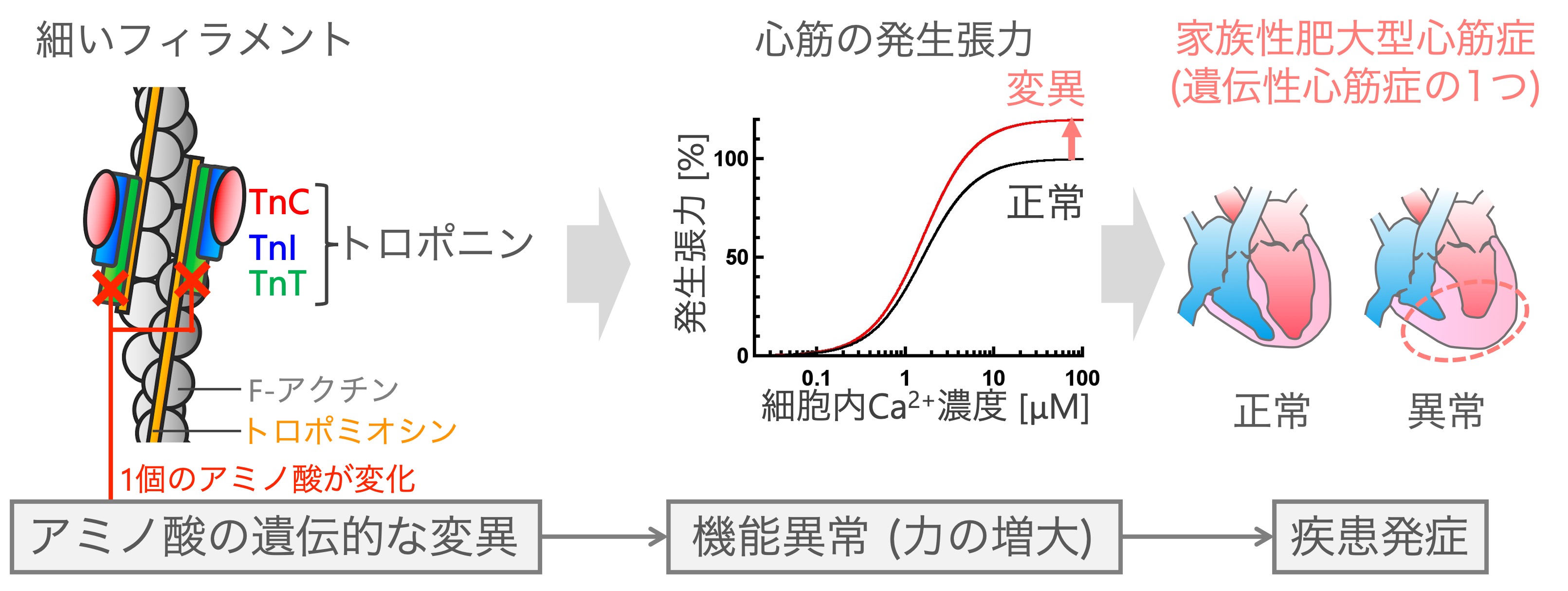
図2. トロポニンの変異による収縮制御機能の異常と心筋症発症の関係. トロポニンT (TnT)を構成するアミノ酸がたった1個変化するだけで, 心筋が発生する力が異常に増大し,最終的には左心室の肥大を引き起こす.
■研究概要 この疑問に答えるため, 私たちは, タンパク質の重要な特性である形や柔らかさを調べることができるX線小角散乱法および中性子準弾性散乱法を用いて,TnTの1アミノ酸変異によってトロポニン,さらには細いフィラメントの形や柔らかさがどう変わるのかを調べました.実験は, 大型の実験施設SPring-8 (兵庫県)やJ-PARC (茨城県)に設置されている装置を用いて行い,コンピュータを利用した解析を行いました.その結果, 変異をもつトロポニンは正常なものよりも柔らかさが増大(つまり, トロポニンが揺らぎやすくなる)し色々な構造を取りやすくなっていること(文献3, 4),この変化によって細いフィラメントがミオシン結合をしやすい方向に形が変えられていること(文献5)が明らかになりました.つまり,変異トロポニンを含む細いフィラメントにはミオシンがより多く結合するために,張力の増大という異常が起こると考えられます.なお, 今回検出した形や揺らぎの変化は数オングストローム(Å; 1 Åは1 mの100億分の1の長さ)程度という非常に小さいもので, これらの研究は, 微細なスケールでタンパク質のふるまいを制御することが私たちの健康に重要であることを示しています.
■科学的・社会的意義 ここで紹介したような研究を進めることで,家族性心筋症が発症する仕組みの全体像が明らかになっていきます.そうすれば,この疾患の症状をコントロールする薬の設計や,それに関連した治療技術の開発が促進されると期待されます.心筋の研究は,心臓が収縮する仕組みを解明するという学問研究としての側面に加え,私たちの生命を脅かす心疾患の予防や治療に役立つ情報が得られるという社会的にも重要な側面の両方を備えています.
■参考文献
| 1 | K. Harada and S. Morimoto, Inherited cardiomyopathies as a troponin disease, Jpn J Physiol, 2004, 54, 307–318. |
| 2 | Y. Maeda, Y. Nitanai and T. Oda, From the crystal structure of troponin to the mechanism of calcium regulation of muscle contraction, Adv. Exp. Med. Biol., 2007, 592, 37–46. |
| 3 | T. Matsuo, S. Takeda, T. Oda and S. Fujiwara, Structures of the troponin core domain containing the cardiomyopathy-causing mutants studied by small-angle X-ray scattering, Biophys. Physicobiology, 2015, 12, 145–158. |
| 4 | T. Matsuo, T. Tominaga, F. Kono, K. Shibata and S. Fujiwara, Modulation of the picosecond dynamics of troponin by the cardiomyopathy-causing mutation K247R of troponin T observed by quasielastic neutron scattering, Biochim Biophys Acta Proteins Proteom, 2017, 1865, 1781–1789. |
| 5 | T. Matsuo, F. Kono and S. Fujiwara, Effects of the cardiomyopathy-causing E244D mutation of troponin T on the structures of cardiac thin filaments studied by small-angle X-ray scattering, J Struct Biol, 2019, 205, 196–205. |
■良く使用する材料・機器
1. 放射光X線 (SPring-8, Photon Factory)
2. 中性子線 (J-PARC, JRR-3, ILL)
3. 実験試薬 (富士フィルム和光純薬株式会社)
 2023年分野別専門委員
2023年分野別専門委員
量子科学技術研究開発機構 量子生命科学研究所
松尾龍人 (まつおたつひと)
「天然のナノマシン・ミオシンが筋肉を収縮させるしくみ」
■背景
動物の大きな特徴は動くことであり、動きの大部分を担うのが筋肉です。自然が作り出した運動装置(アクチュエータ)ですが、生き物の筋肉のように軽量・高出力で、しなやかに働く人工のアクチュエータは開発されていません。筋肉を分子レベルまで分けて見ると、ミオシンというタンパク質がアクチンフィラメントという繊維状のタンパク質を一方向に引っ張ることで収縮することが知られています(図1A)。ミオシンは力を出すのでモータータンパク質と呼ばれますが、このようなナノサイズのマシンはどのような仕組みで動くのでしょうか。
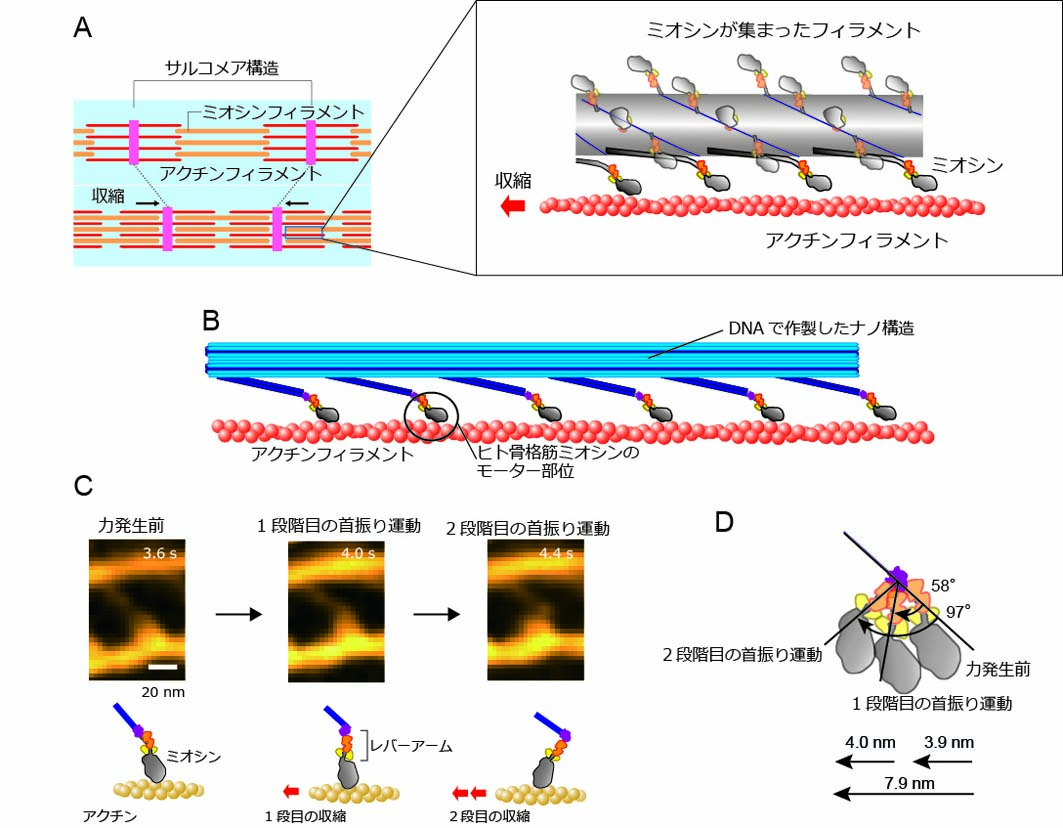
図1 A 筋肉の構造。B 筋肉構造の一部を再現した人工ナノ筋肉。C 高速原子間力顕微鏡で画像化したミオシンの首振り運動。D ミオシンの構造変化の結果。(文献1より改変して引用)
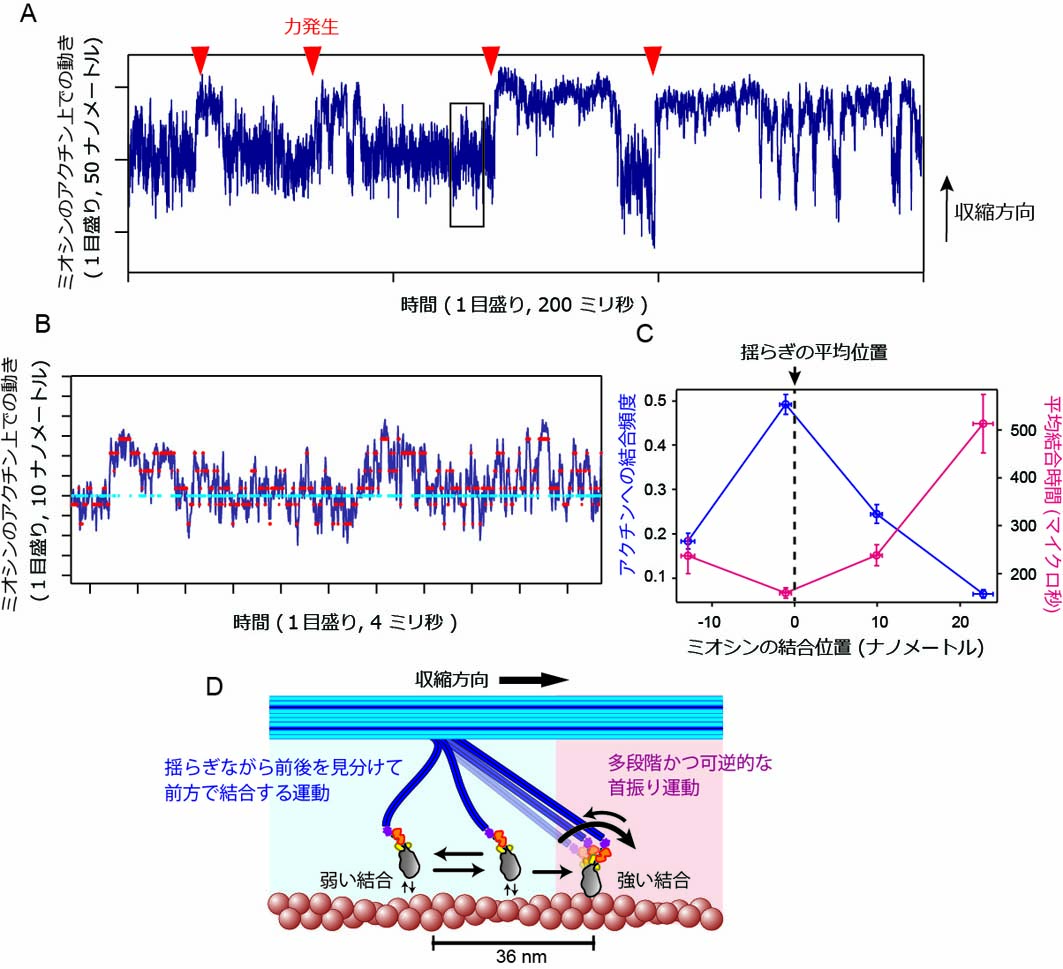
図2 A アクチンの軸方向へのミオシンの動き。赤矢印のところで一方向の力発生が起こる。B 力発生直前の動き(図Aの四角で囲った部分)の拡大図。青点線は揺らぎの平均位置で、赤線はアクチンに弱く結合している状態。C 青線:アクチンへの結合頻度、赤線:アクチンへの結合時間。右側(前方)で結合時間が長くなる。D 筋肉を収縮させるミオシンの一連の動き(文献1より改変して引用)
■研究概要
人工の機械とはおそらく異なる原理で働くであろうミオシンの動作原理を調べるために、本研究では、筋肉の構造の一部を厳密に再現する「人工ナノ筋肉」と名付けたシステム(図1B)を開発して、その中で働くミオシン1個ずつの動きを詳細に観る顕微鏡を構築してきました。高速原子間力顕微鏡を用いるとミオシンの構造が段階的に変わっていく様子が見えるようになり、生物の教科書に書かれている首振り運動を直接的に画像化することができました(図1C-D)。また、レーザー暗視野顕微鏡を用いて高速撮影を行うと、ミオシンがアクチンフィラメントに沿ってゆらゆらと前後に揺らいでいて(図2A)、前方のアクチンに偶然に結合すると安定化されて首振り運動が起こるという一連の流れが見えてきました(図2B-D)。ミオシンが揺らぎながら前後を見分ける運動は教科書にもまだ記載のない仕組みで、筋肉が生き物らしく柔軟に動く様子が分子レベルから起こっていることを明確に示しました。
■科学的・社会的意義
本研究によって人工のアクチュエータとは全く異なる動作原理が明らかにされ、生き物らしいしなやかなアクチュエータを開発するためのヒントを与えてくれます。また、ミオシンが変異して動きがおかしくなることで引き起こされる心臓の病気などが知られています。このような病気のメカニズムを分子レベルで分析し、ミオシンに直接作用する薬の候補を見つけるのに、人工ナノ筋肉や1分子レベルでの分析技術がとても役立ちます。
■参考文献
1)K. Fujita, M. Ohmachi, K. Ikezaki, T. Yanagida, M. Iwaki (2019). "Direct visualization of human myosin II force generation using DNA origami-based thick filaments" Communications Biology, 2, 437.
2)岩城光宏、柳田敏雄 (2021) “人工ナノ筋肉を用いた筋収縮原理の解明” 「生体の科学」特集「新組織学シリーズII:骨格筋ー最新の筋病学を中心に」第72巻6号, 510-514
■良く使用する材料・機器
1) 蛍光顕微鏡システム IX-71 (オリンパス株式会社)
2) 顕微鏡用光学部品 (ソーラボジャパン・シグマ光機)
3) デジタルCMOSカメラ ORCA-Flash (浜松ホトニクス株式会社)
 2022年分野別専門委員
2022年分野別専門委員
理化学研究所・生命機能科学研究センター
岩城光宏 (いわきみつひろ)
http://www.qbic.riken.jp/cdo/iwaki-subg/index.html
「心筋収縮系の運動特性:自励振動現象(SPOC)と心拍」
心臓は、ペースメーカー細胞の生み出す電気信号に応じて休むことなく収縮と弛緩を繰り返し、私たちの体に血液を送っています。ペースメーカー細胞は心臓の上部に存在して周期的に興奮(脱分極)し、心臓内の決まった経路に沿って電気信号を心筋細胞に伝えています。このペースメーカー細胞の興奮にともなう心臓の収縮・弛緩の頻度を、私たちは心拍数(毎分何拍か、で表す)と呼んでいます。ここでは、私たちの生命活動になくてはならない心臓のリズムがどのように調節されているのか、最近の知見に基づいて解説したいと思います。
1)心筋の収縮の仕組み
心臓は、階層構造を持っている臓器です。つまり、心臓⇔心筋細胞⇔サルコメア(超分子集合体)⇔タンパク質(アクトミオシン分子モーター)という階層構造が存在します(図1)。逆に言えば、アクトミオシン(アクチン-ミオシン)分子モーターの集合体がサルコメアを構築し、サルコメアの集合体が心筋細胞を構築し、そして心筋細胞の集合体が心臓を構築しています。サルコメアは、長さ~ 2μm、幅~ 1μm の構造体で、心筋細胞内の収縮装置、すなわち収縮系を構成している最小ユニットです。サルコメアが直列につながったものを筋原線維と呼び、筋原線維が束になったものを筋線維と呼びます。サルコメアには、よく知られている太いフィラメントと細いフィラメントに加え、タイチン(コネクチン)と呼ばれる弾性フィラメントが存在します。タイチンは、サルコメアの静止張力の発生に寄与している巨大な弾性タンパク質で、その大きさは約3-4 MDaであることが知られています。タイチンの生理的役割はこれまであまり知られていませんでしたが、最近の研究によって、サルコメア形成時に太いフィラメントと細いフィラメントの長さを決定する“ものさし”としての役割を果たしていること(論文1)、また、外力に応じ、それ自体が伸び縮みしてサルコメアの構造を変化させ、サルコメアの収縮力を可逆的に、かつ瞬時に調節している仕組みが明らかになっています(論文2,3)。太いフィラメントを構成するミオシンは、細いフィラメントの主要な構成要素であるアクチン分子と相互作用し、ATPを加水分解することによって力学的な力を発生します(注:太いフィラメント、細いフィラメントは、それぞれミオシン分子、アクチン分子が重合してできています)。一分子生理学の発達によって、ミオシン一分子がATPの化学エネルギーをどのように力学エネルギーに変換しているのか、その仕組みが明らかになっていますが、この説明は本稿では割愛します。細いフィラメントにはカルシウムイオン受容タンパク質であるトロポニンが存在し、カルシウムイオンがこれに結合することで細いフィラメントの構造が変化し、ミオシンとアクチンの相互作用が可能になります。ですから、トロポニンは、筋収縮においてON-OFFスイッチとしての役割を果たしていると言うことができます。では、次に、心筋細胞内において、カルシウムイオン濃度がどのように調節されているのか、その仕組みを見てゆきましょう。
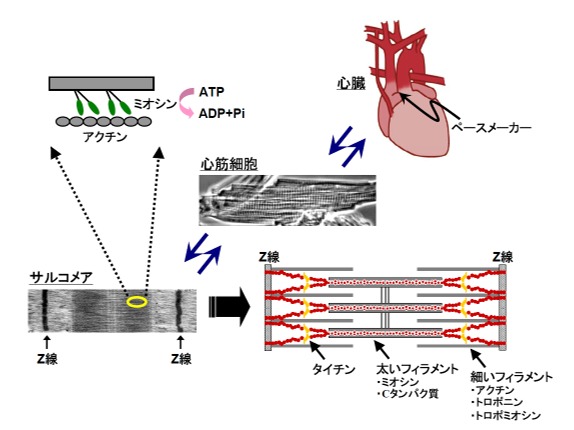
図1: 心臓の階層構造。サルコメア、心筋細胞、そして心臓という階層構造が存在します。心臓の上部には洞房結節があり、他からの刺激なしに自動性の活動電位を規則正しく発し、ペースメーカーとしての役割を果たしています。サルコメアは、異なる種類の生体分子が多数集まって構築されている超分子集合体で、その中には三種類のフィラメント(太いフィラメント、細いフィラメント、タイチン)があります。ミオシン分子はATPをADPと無機リン酸(Pi)に加水分解し、その化学エネルギーを力学エネルギーに変換する分子モーターです。心筋、骨格筋を問わず、筋収縮は、太いフィラメントと細いフィラメントが滑り込むようにして起こっています。そして、この収縮力が血液を拍出するという、心臓のポンプ機能を生み出しているのです。
心筋細胞の細胞膜では、ペースメーカーの活動に応じて周期的な電気的活動が起こっており、これが心臓を規則正しく、かつ協調的に拍動させる源になっています(図2)。この電気現象は、活動電位と呼ばれています。活動電位とは、細胞膜におけるイオン(主に、ナトリウムイオン、カリウムイオン)の通過にともなう細胞内外での一過的な電位の変化のことで、全ての興奮性細胞において生じます。すなわち、ナトリウムイオンおよびカリウムイオンが細胞膜に存在するイオンチャネルを通って移動するプロセスを通じて膜電位が変化するのです。A.L. HodgkinとA.F. Huxleyはこの一連の過程を定式化することに成功し、1963年にノーベル生理学医学賞を受賞しました。心筋細胞が他の興奮性細胞と違ってユニークな点は、活動電位の時間が長いこと、その間にカルシウムイオンが細胞内に流れ込んでくるということです。ですが、細胞外から流れ込んでくるカルシウムイオンが、心筋サルコメアの収縮を直接誘起するわけではありません。心筋細胞内には筋小胞体と呼ばれるカルシウムイオンの貯蔵庫が存在するのですが、細胞外から流れ込んできたカルシウムイオンは筋小胞体を刺激し、その中のカルシウムイオンが放出されてトロポニンに結合し、筋収縮のスイッチがONになるのです。心臓の拡張期には、細胞内のカルシウムイオンは、筋小胞体にあるポンプによって再び筋小胞体の内部に取り込まれ、トロポニンからカルシウムイオンが乖離し、筋収縮のスイッチがOFFになります。
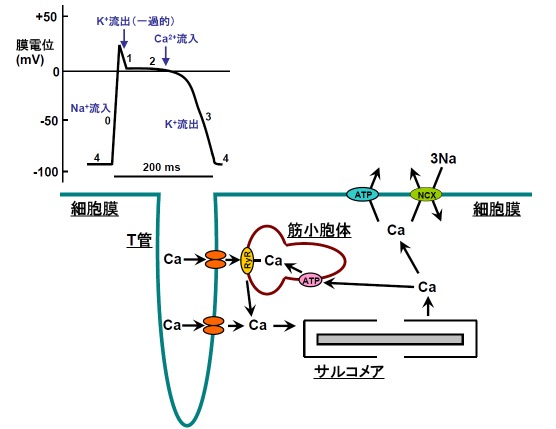
図2: 心筋細胞における興奮収縮連関の模式図。左上は心筋細胞の膜電位を示します。活動電位の各相は、第0相から第4相までの番号で呼ばれることもあります。図では、各相におけるイオンの流れを示してあります。第0相においてナトリウムイオンが細胞内に流入すると、膜電位に依存したカルシウムチャネルが開口し(オレンジ)、細胞内にカルシウムイオン(Ca)が流入します(第2相)。このカルシウムイオンは筋小胞体にあるリアノジン受容体(RyR)を刺激して、細胞内にカルシウムイオンが放出されます。トロポニンに結合したカルシウムイオンはサルコメアの収縮を誘起しますが、細胞内のカルシウムイオン濃度が低下すると、トロポニンからカルシウムイオンが乖離し、サルコメアは弛緩します。細胞内のカルシウムイオン濃度が低下するメカニズムは主に二つあります。一つは、筋小胞体のカルシウムポンプ(ATP駆動型)によって再び筋小胞体内に取り込まれるメカニズム、もう一つはNa-Ca交換系(NCX)によって細胞外に出てゆくメカニズムです。動物種にもよりますが、一般に、前者の方が後者よりも使われている比率が高いことが知られています。ごく一部は、細胞膜にあるカルシウムポンプ(ATP駆動型)によって細胞外にくみ出されます。このように、心筋細胞内のカルシウムイオン濃度は、細胞膜の電気的興奮に基づいて厳密にコントロールされているのです。
2)自励振動現象(SPOC)
上で見てきたように、心臓の拍動調節においては、カルシウムイオンがその中心に座っていて、収縮系は細胞内カルシウムイオン濃度の変化に応じて収縮と弛緩を繰り返すだけの単純なON-OFF装置であるように見えます。しかしながら私たちの研究グループは、収縮レベルの低い中間活性状態(例えばカルシウムイオン濃度が10-6 M程度の時)において、心筋の収縮系が自発的に振動するという現象(SPOC)を発見しました(論文4,5)。すなわち、中間活性状態において、サルコメアには力を発生する分子モーターと力を発生しない分子モーターが共存することになりますが、これらが半サルコメア単位で共同作業を行うことによってSPOCが誘起されるのです。このことは、SPOCが、溶液環境の変化にともなって生じる、いわゆる化学振動とは異なり、心筋収縮系自体の力学特性が加わった、非常にユニークな非線形の化学力学振動であることを示しています。また大切なことは、心筋では収縮期においてさえも細胞内カルシウムイオン濃度が10-6 M程度までしか上がらないという点です(注:骨格筋では、収縮にともなって細胞内カルシウムイオン濃度は10-5 M程度まで上昇し、ほぼ全てのアクトミオシン分子モーターが活動します)。つまり、心筋においてSPOCが起きる条件というのは極めて生理的だと言うことができます。ですから、カルシウムイオン濃度の変化とは独立に中間活性状態において心筋が自発的に振動するという事実は、収縮系が心拍調節に関与していることを強く示唆していると考えられます。実際、私たちは、SPOCの振動数と動物の静止時の心拍数との間に強い相関があることを見出しています(論文6,7)。すなわち、心拍数の高い小動物の心筋ではSPOCの振動数は高く、心拍数の低い大動物の心筋ではその振動数は低いことが分かりました。心筋の収縮系にとって、SPOCは固有振動に相当し、心拍由来の細胞内カルシウム濃度変化は強制振動に相当します。SPOCの振動数と心拍数との間に強い相関があるという事実は、心臓拍動におけるSPOCの生理的意義の可能性を強く示唆し、従来の心臓の拍動メカニズムの理解に新たな視点を与えるものと言うことができるでしょう。SPOCの生理的意義を明らかにするため、私たちは現在、生きた小動物の心臓から一個の心筋細胞の細胞内情報(カルシウムイオン濃度やサルコメア長など)を抽出する技術の開発に取り組んでいます。
[参考文献]
[1] J. Udaka, S. Ohmori, T. Terui, I. Ohtsuki, S. Ishiwata, S. Kurihara, N. Fukuda. Disuse-induced preferential loss of the giant protein titin depresses muscle performance via abnormal sarcomeric organization. Journal of General Physiology 131, 33?41, (2008).
[2] N. Fukuda, D. Sasaki, S. Ishiwata, S. Kurihara. Length dependence of tension generation in rat skinned cardiac muscle: role of titin in the Frank-Starling mechanism of the heart. Circulation 104, 1639-1645, (2001).
[3] N. Fukuda, Y. Wu, G. Farman, T. C. Irving, H. L. Granzier. Titin isoform variance and length dependence of activation in skinned bovine cardiac muscle. Journal of Physiology (London) 553, 147-154, (2003).
[4] N. Fukuda, H. Fujita, T. Fujita, S. Ishiwata. Spontaneous tension oscillation in skinned bovine cardiac muscle. Pflugers Archiv 433, 1-8, (1996).
[5] N. Fukuda, S. Ishiwata. Effects of pH on spontaneous tension oscillation in skinned bovine cardiac muscle. Pflugers Archiv 438, 125-132, (1999).
[6] D. Sasaki, H. Fujita, N. Fukuda, S. Kurihara, S. Ishiwata. Auto-oscillations of skinned myocardium correlating with heartbeat. Journal of Muscle Research and Cell Motility 26, 93-101, (2005).
[7] D. Sasaki, N. Fukuda, S. Ishiwata. Myocardial sarcomeres spontaneously oscillate with the period of heartbeat under physiological conditions. Biochemical and Biophysical Research Communications 343, 1146-1152, (2006).
東京慈恵会医科大学・細胞生理学講座 福田 紀男
