光合成
「光エネルギー変換を担う色素:クロロフィル」
■背景
光を用いて高エネルギー化合物を合成する反応が「光合成」ですが、光合成反応自体は数10~100ステップからなる素過程によって構成されています。その中で、最も「光」「合成」らしさを示す反応が、光によりエネルギーが供給され、特別なクロロフィルがおこなう電荷分離(電子が飛び出す)反応です。しかし、太陽光は希薄なため濃縮しないことには電荷分離できません(虫眼鏡で紙を燃やすように)。光を濃縮するには、漏斗の入り口の様にクロロフィル等の光合成色素が光エネルギーを捕まえて、漏斗の出口の様に光エネルギーを移動させ濃縮する必要があります(図1A)。光を濃縮した後、電荷分離を担う特別なクロロフィルにエネルギーを渡すことで、電子が飛び出し(図1B)、その後電子はタンパク質中に存在する電子伝達成分(鉄やキノンなど)を移動していきます。電子は最終的にNADP+という物質に渡されNADPHという高エネルギー化合物ができます。一方、電子の足りなくなった特別なクロロフィルは近傍に存在するマンガンクラスターを通じて水から電子を引く抜くことにより、電子が供給され、その結果、水が分解され酸素発生する仕組みになっています。
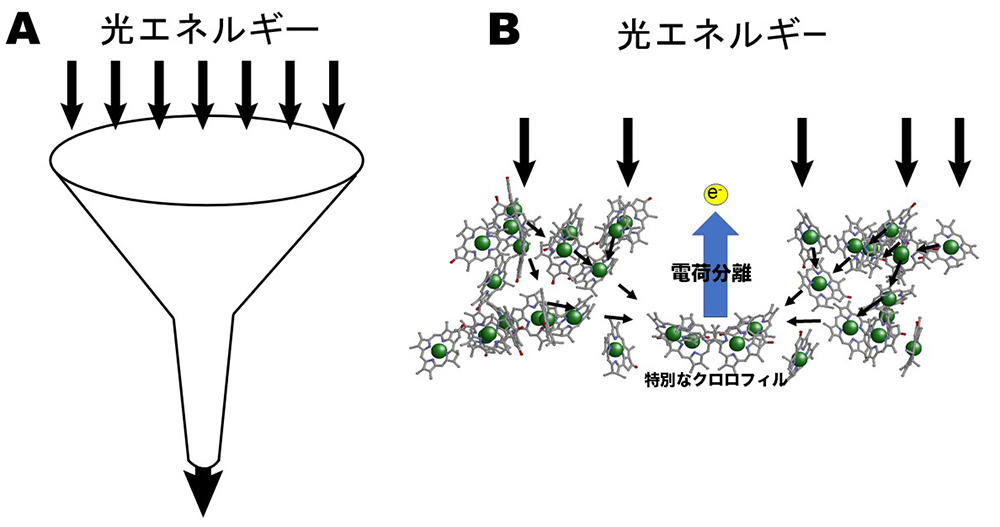
図1 A:漏斗のように希薄なエネルギーを集光するイメージ。B:膜タンパク質中でのクロロフィル配置のイメージ。光エネルギーがクロロフィル間を伝達して、最後に特別なクロロフィルで電荷分離を生じる。
■研究概要
クロロフィルは膜タンパク質に埋め込まれおり、酸素発生型光合成では、電荷分離をおこなうタンパク質1単位あたり、数10~100分子のクロロフィルが存在しています(図1B)。このクロロフィルのほとんどは希薄な太陽光を濃縮するアンテナとしての役割を担っており、電荷分離をおこなう特別なクロロフィルにエネルギーを濃縮(エネルギー移動)しています。種々のクロロフィルの吸収スペクトルを図2Aに示します。生物種によってクロロフィル種は異なりますが、全ての酸素発生型に共通して存在するクロロフィルはクロロフィルaと呼ばれるものです。クロロフィルの働きを明らかにすることが光エネルギー変換反応の理解につながります。私たちの研究室ではクロロフィルaばかりでなく近赤外領域に吸収極大をもつクロロフィルdやクロロフィルfも材料としています(図2A、文献1, 2)。これらのクロロフィルのエネルギー移動機構や電荷分離の仕組みについて種々の分光法(吸収、蛍光、偏光の定常および時間分解)を用いて、その局在位置や吸収位置を明らかにすることを進めています。膜タンパク質に埋まっているクロロフィル分子には違いはありませんが、埋まっている環境が異なる(周囲のアミノ酸環境が個々に違う)ことにより、クロロフィルの吸収帯がシフトします(図2B)。結果として、個々のクロロフィルのエネルギーレベルが異なるため、エネルギーの高いクロロフィルから低いクロロフィルにエネルギー移動して、光の濃縮を実現しています。
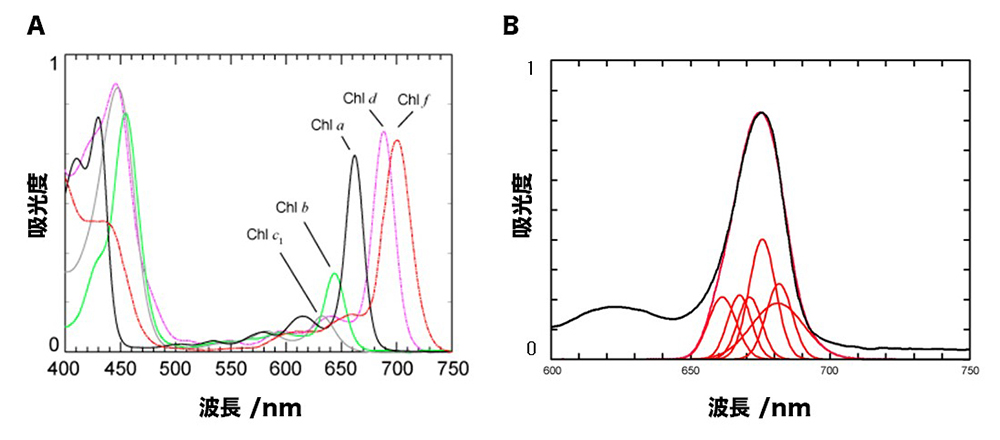
図2 A: 種々のクロロフィル吸収スペクトル(有機溶媒中)。B: タンパク質中のクロロフィルのスペクトル。6成分(赤)のクロロフィルが重なって一つのピークを形成している(黒)。
■科学的・社会的意義 諸説ありますが酸素発生型光合成をおこなう原核生物のシアノバクテリアは27億年前の地球に誕生し、進化をつづけてきた結果、タンパク質中クロロフィルの光エネルギー移動および電荷分離後の電子移動の量子収率はほぼ100%という高い効率を実現しています。ほぼ無尽蔵に存在すると考えられる太陽光と電子源としての水を用いる光合成光エネルギー変換の原理を明らかにすることは、持続可能な再生エネルギー系を確立するために必須な事項と言えます。また、自然が確立したこの効率の良い系を応用することで人工光合成の効率も高まることが期待されます。
■参考文献
1)Tomo, T. et al. (2007). "Identification of the special pair of photosystem II in a chlorophyll d-dominated cyanobacterium." Proc Natl Acad Sci 104(17): 7283-7288.
2)Tomo, T., Shinoda, T., et al. et al. (2014). "Energy transfer processed in chlorophyll f-containing cyanobacteria using time-resolved fluorescence spectroscopy on intact cells. "Biochim. Biophys. Acta 1837: 1484-1489.
■良く使用する材料・機器
1) 微分緩衝顕微鏡システム BX51 (株式会社OLYMPUS)
2) 実験試薬 (和光純薬株式会社)
3) 吸収・蛍光分光システム (日本分光)
H29年度分野別専門委員
東京理科大学・理学部・理学研究科
鞆達也 (ともたつや)
https://www.rs.kagu.tus.ac.jp/tomo/
「酸素を発生しない光合成明反応の仕組みを探る」
■背景
最古の光合成生物は地球誕生後約10億年の時代に既に存在していたと推定されます。当時の地球上は水素や硫化水素などの還元的大気に包まれていたと考えられています。これらの原始的な光合成微生物(細菌)は水素や硫化水素を電子供与体として分子状酸素の発生を伴わずに太陽の光エネルギーで炭酸固定を行っていたと推測されていますが(図1)、現代植物の光合成とどこがどのように違うのでしょうか?
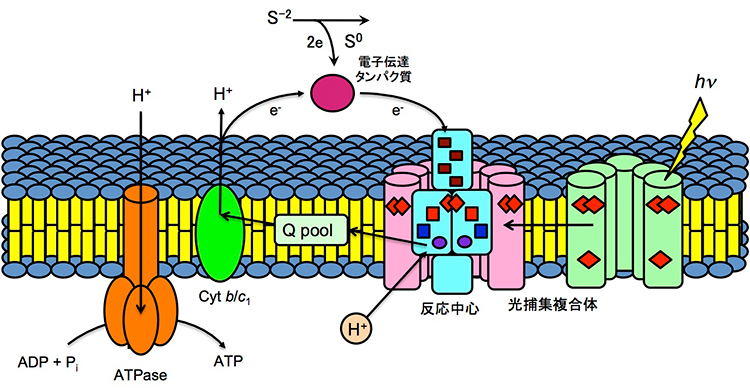
図1 紅色硫黄光合成細菌における光合成初期反応の模式図
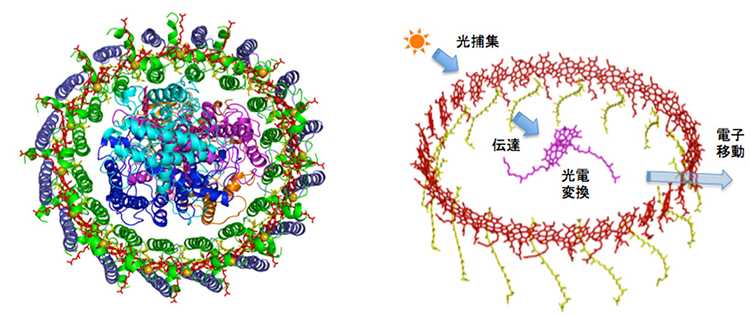
図2 光捕集反応中心複合体の結晶構造(左)とその中の色素配置(右)
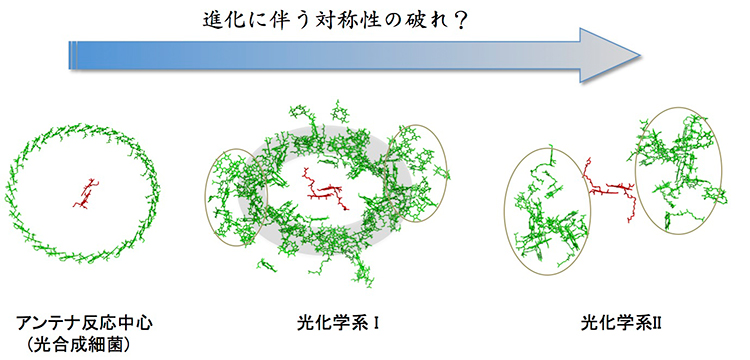
図3 アンテナ色素配置の変遷ぶり
■研究概要
この疑問に答えるため、紅色硫黄光合成細菌を用いて、光合成の初期過程において光捕集を担うアンテナと光電変換を司る反応中心からなる超分子複合体の構造と機能を生物物理化学的手法で調べています。十年以上の歳月をかけて好熱性細菌から単離されたアンテナ反応中心複合体の立体構造を明らかにしました。
アンテナは2重リングの形で反応中心を取り囲んでいます。32個の光捕集色素分子(バクテリオクロロフィル)が、光電変換を行う2個の色素分子の周りに閉じた楕円形を形成しています(図2)。この好熱性細菌のアンテナにはさらに16個のカルシウムイオン(Ca2+)が結合していることも確認されました。これらのCa2+はアンテナの吸収波長や複合体全体の熱耐性にも重要な役割を果たしていることがわかりました。
光合成細菌のアンテナと反応中心に見られる色素配置の特徴は現代植物の光合成系にも保存されています(図3)。反応中心を取り囲むアンテナの色素配置は進化とともに完全対称から、部分対称、さらに低い対称性へと移り変わっていく様子が見られます。しかし、色素の数や本来の機能であるエネルギー捕集と伝達の機能においては基本的に変わっていないとも言えます。このように、光合成誕生後の比較的早い段階で光エネルギーの吸収と光電変換系が既に最適化され、ほぼ完結されたと考えることができます。
■科学的・社会的意義 植物の祖先に当たる光合成細菌の研究によって、30数億年にわたる光合成進化の道筋をたどることができるとともに、光合成の最も本質的な原理を理解することができます。一方、本研究の好熱性細菌から単離された光合成色素膜タンパク質は熱に対して極めて安定であり、最もシンプルな天然光合成系の研究材料として好適だけではなく、今後期待される人工光合成への応用にも優れていると考えています。またその性質に金属イオンが深く関与していることから、色素膜タンパク質と金属イオン間における高度な分子認識機構の解明とともに、生物の極限な自然環境への適応戦略の解明にもつながります。
■参考文献
1)Niwa, S., Yu, L.-J., Takeda, K., et al. (2014). "Structure of the LH1-RC complex from Thermochromatium tepidum at 3.0 Å" Nature 508, 228-232.
2)Kimura, Y. et al. (2009). "Calcium ions are required for the enhanced thermal stability of the light-harvesting-reaction center core complex from thermophilic purple sulfur bacterium Thermochromatium tepidum" J. Biol. Chem. 284, 93-99.
3)Kimura, Y. et al. (2008). "Calcium ions are involved in the unusual red-shift of the light-harvesting 1 Q
■良く使用する材料・機器
1) 分光光度計 (ベックマン・コールター株式会社)
2) 高速液体クロマトグラフィー (株式会社日立ハイテクノロジーズ、日本分光株式会社)
3) MALDI TOF/MS質量分析計 (株式会社エービーサイエックス)
H27年度分野別専門委員
茨城大学・理学部
大友征宇 (おおともせいう)
https://biophys.sci.ibaraki.ac.jp
「光合成における酸素発生のしくみを赤外光を使って探る」
■背景
植物や藻類が行う光合成では、光エネルギーを用いて水を分解し、酸素を発生します。 それは、二酸化炭素を還元して糖を合成するのに必要な電子を水から得るためです(図1)。人間を含めた多くの生命は、この光合成によって発生した酸素を使って呼吸し、エネルギーを得ています。
光合成の酸素発生反応は、光化学系Ⅱと呼ばれるタンパク質で行われます。光化学系Ⅱはクロロフィル、フェオフィチン、キノンなどの色素を結合しており、光エネルギーを用いてそれらの色素上で電子を動かします(図2A)。そして、電極の役割をするマンガンクラスター(マンガン原子4つとカルシウム原子1つよりなる:図2B、文献1)で2分子の水を酸化し、酸素分子と4つのプロトンとに分解します。2H2O → O2 + 4H+ + 4e- の化学式からわかるように、水を分解するには、4つの電子を引き抜く、つまり、4回の光照射による電子移動が必要です。そのため、光によって駆動される、S状態と呼ばれる5つの中間状態のサイクル(S状態サイクル)によって反応を行います(図2C)。
光合成生物のみならず、地球に棲む他の生命にとっても大変重要な酸素発生反応ですが、そのしくみは未だよく理解されていません。
図1 葉緑体中で行われる光合成過程
図2(A)光化学系Ⅱの電子移動経路;(B)酸素発生中心(Mn4CaO5クラスター)の構造;(C)中間状態サイクル(S状態サイクル)(D) 酸素発生反応による赤外吸収変化
■研究概要 私達は、光合成の水分解による酸素発生のしくみを、赤外光を用いた測定によって解き明かそうとしています。赤外光の吸収を測定することにより、個々の分子の振動を検出し、その構造や反応を調べることができます。レーザーからの閃光(1億分の1秒くらいの幅を持つ光)を数秒間隔で光化学系Ⅱタンパク質に照射し、その間の一万分の一以下の微小な赤外吸収変化を検出することにより、巨大タンパク質中での水分子の反応やアミノ酸の反応を捉えました(図2D、文献2-4)。また、この方法を用いて、光吸収によって電子を動かす色素分子の反応を検出し、水から引き抜かれた電子がどのようなしくみでタンパク質中を移動していくのかを調べています。
■科学的・社会的意義
生命は約25億年前に光合成システムを完成させ、太陽光エネルギーと水を使って化学エネルギーを得る手段を得たと考えられています。これによって、生命は太陽光という無限のエネルギー源を獲得して地球上で繁栄し、さらに酸素呼吸を行う多様な生物へと進化していきました。光合成による光エネルギー変換や酸素発生のしくみを解明することは、生命がなぜこの地球上で存在できるのか、という基本的な疑問への答えを与えます。
現在、人類は自らの技術を使って光合成を行う「人工光合成」を実現しようとしています。生命が太古の時代に光合成を実現して地球生命のエネルギー問題を解決したように、人工光合成が完成すれば、現在人類が直面するエネルギー問題や地球温暖化問題を根本的に解決することができます。生命が行う光合成のしくみを完全に理解することは、効率の良い人工光合成システムの実現に必要不可欠です。
■参考文献
1)Y. Umena, K. Kawakami, J. R. Shen and N. Kamiya, Crystal structure of oxygen-evolving photosystem II at a resolution of 1.9 Å. Nature 473, 55-60 (2011).
2)T. Noguchi and M. Sugiura, FTIR detection of water reactions during the flash-induced S-state cycle of the photosynthetic water oxidizing complex, Biochemistry 41, 15706-15712 (2002).
3)T. Noguchi, Fourier transform infrared analysis of the photosynthetic oxygen-evolving center, Coord. Chem. Rev. 252, 336-346 (2008).
4)H. Suzuki, M. Sugiura and T. Noguchi, Monitoring proton release during photosynthetic water oxidation in photosystem II by means of isotope-edited infrared spectroscopy, J. Am. Chem. Soc. 131, 7849-7857 (2009).
■良く使用する材料・機器
1) フーリエ変換赤外分光計 VERTEX 80 (ブルカー・オプティクス株式会社)
2) パルスNd:YAGレーザー INDI (スペクトラ・フィジックス株式会社 )
H26年度分野別専門委員
名古屋大学・理学研究科
野口巧(のぐちたくみ)
https://www.glab.phys.nagoya-u.ac.jp/
