機械受容
「生物で起こる機械信号から化学信号への情報変換」
■背景
センサー(sensor)という言葉を聞いたことがあると思います。一般に、センサーは、何らかの物理的情報を感知して、別の情報へと変換する要素のことを言います。例えば、カラオケで手にするマイクは音を電気信号に変換する音センサーです。温度計や光量計もそれぞれ温度センサー、光センサーと言えます。
細胞にも様々なセンサーがあり、生体の成長や健康の維持に重要な役割を果たしています。2012年のノーベル化学賞では、ホルモンや神経伝達物資、光、においなどの細胞センサー(Gタンパク質共役受容体)が受賞対象となりました。昨今の研究から、Gタンパク質共役受容体とは限らない新しいタイプの細胞センサーとして、力(ちから)のセンサー(メカノセンサー・mechanosensor, mechanoreceptor)が存在しており(図1)、やはり生命にとって重要な役割を果たしていることが明らかになっています。
「機械受容」【対応する英語としてはmechanoreception、もしくは(直訳すると「力変換」ですが)メカノトランスダクション・mechanotransduction、あるいは機械的刺激を知覚することからメカノセンシング・mechanosensingなどの言葉が使われます】とは、そのようなメカノセンサーが果たす役割そのもの、つまり機械的(力学的・mechano-)情報を生化学的情報(イオンチャネルの開閉、酵素活性の制御、タンパク質との結合の調整など)に変換すること、あるいはメカノセンサーを使って細胞が自らに負荷された「力」に応答する過程全体を指す言葉です。
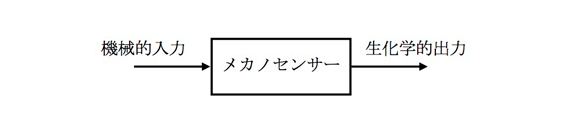
図1 機械受容における細胞内のメカノセンサーの役割
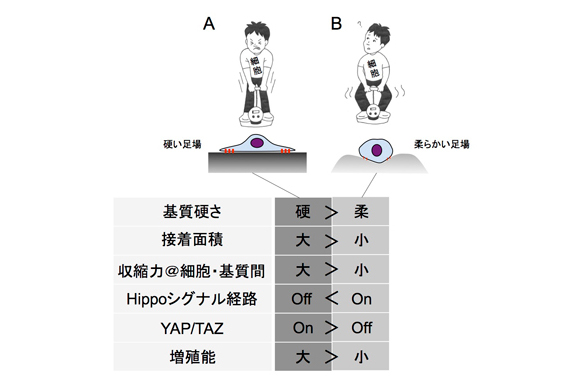
図2 細胞は、自身が接着する基質(足場)の硬さを認識して応答を変えます。力は、力学の作用・反作用の法則に従って現れます。従って硬い足場の上では、細胞内ミオシンに起因する細胞収縮力が大きい(A)。しかし柔らかい足場の上では、「のれんに腕押し」状態となり、細胞収縮力は小さい(B)。この収縮力の大きさの違いを(一例として)図3に示す細胞内外の要素が感知して、異なる細胞応答(一例として、図2中の下欄に示したもの)を引き起こします(文献1・2)。
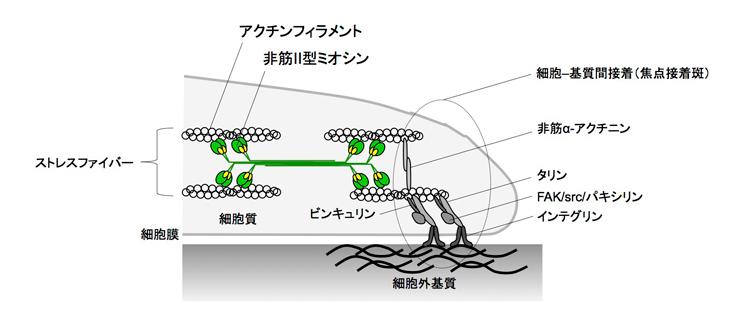
図3 細胞は、面全体を使ってべっとりと外部と接着するのではなく、細胞接着(焦点接着斑・focal adhesions)と呼ばれる細胞内要素を用いて局所的に外部と接着します。この図は、その細胞接着や、それに結合する細胞骨格や細胞外基質の模式図です。細胞収縮力を感知するメカノセンサーは、ここで示す構造物内に存在しています。他にも細胞膜内張力に反応するイオンチャネル(stretch-activated channel)も古くから研究されています(文献3)。
■研究概要 細胞は周囲の組織の「硬さ」を感知して、応答を変えることがわかっています(図2・3)。一例を挙げると、間葉系幹細胞では細胞外基質の硬さに応じて分化誘導される細胞種が異なる、つまり細胞の運命が力学環境によって左右されることが明らかにされています(文献4・5)。このとき、何がメカノセンサーであるか、そしてメカノトランスダクションが起こった後の特定のシグナル伝達分子経路(またそれに伴う細胞骨格や遺伝子発現の変化など)がどのようなものであるかが研究されています。このように「力」が生命現象に果たす役割を分子レベルで調べる研究領域はメカノバイオロジー(mechanobiology)と呼ばれています(文献6・7)。また、生物物理学的観点からは、特定のメカノセンサーがどのようにメカノトランスダクションを起こして生化学的シグナルを引き起こすか(どのような構造変化を伴うか、またはどのように揺らぎが変わるかなど)がとりわけ興味深い研究対象となっています。
■科学的・社会的意義 機械受容は発生や健康の維持、疾患の発症とも密接な関係がある、重要な研究課題です。機械受容の研究(メカノバイオロジー)では「力」が主役となります。関連分子の特定を基に理解を進める分子生物学にとって、力は捉えづらい(可視化しづらい)要素です。また、従来の生物物理学では個々のタンパク質など特定の構成要素だけを研究対象とすることが多かったのに対して、メカノバイオロジーでは複合タンパク質あるいは個々の細胞、ひいては組織全体がどのような力学環境にさらされており、各階層でどのように応答するのかを分子レベルで明らかにすることが求められます。このような複雑で捉えづらい問題の理解には、生物物理学研究がこれまで積み上げてきた1分子(の研究は勿論難しいが、1分子だけを見ていればよかった単純な系)の問題解決法だけでは不十分であり、さらなる学際的・複合的なアプローチが求められます。それだけに機械受容の問題は、研究内容が重要であるだけでなく、生物物理学研究の有効性・開拓性に挑戦をかける興味深い研究対象であると言えます。
■参考文献
1)Dupont, S., Morsut, L., Aragona, M., Enzo, E., Giulitti, S., Cordenonsi, M., Zanconato, F., Digabel, J.L., Forcato, M., Bicciato, S., Elvassore, N., Piccolo, S. (2011) "Role of YAP/TAZ in mechanotransduction. " Nature 474: 179-183.
2)Wada K., Itoga K., Okano T., Yonemura S., Sasaki H. (2011) "Hippo pathway regulation by cell morphology and stress fibers. " Development 138: 3907-3914.
3)Naruse, K., Sokabe, M. (1993). "Involvement of stretch-activated ion channels in Ca2+ mobilization to mechanical stretch in endothelial cells." American Journal of Physiology-Cell Physiology 264: C1037-C1044.
4)Chen, C.S., Mrksich, M., Huang, S., Whitesides, G.M., Ingber, D.E. (1997) "Geometric control of cell life and death." Science 276: 1425-1428.
5)Engler, A.J., Sen, S., Sweeney, H.L., Discher, D.E. (2006) "Matrix elasticity directs stem cell lineage specification." Cell 126: 677-689.
6)曽我部正博編.細胞力覚 発生・再生と疾患を制御する力学的コミュニケーション.細胞工学 31: 2012年9月号.学研メディカル秀潤社.
7)曽我部正博編.メカノバイオロジー 細胞が力を感じ応答する仕組み.DOJIN BIOSCIENCE SERIES.2015.化学同人.
■良く使用する材料・機器
1)共焦点レーザー顕微鏡(オリンパス株式会社)
2)光学素子・部品(ソーラボジャパン株式会社)
3)実験試薬(和光純薬工業株式会社)
 H26年度分野別専門委員
H26年度分野別専門委員
名古屋工業大学・共同ナノメディシン科学専攻
出口真次 (でぐちしんじ)
https://mbl.web.nitech.ac.jp/index.html
