熱測定
熱測定で核酸医薬の標的認識メカニズムに迫る
■背景
核酸医薬品の一つに、アプタマーとよばれるものがあります。アプタマーは、ラテン語で適合するという意味を持つ語(aptus)と核酸分子を表わすオリゴマーの接尾語(mer)を合わせた合成語です。アプタマーは、人工的につくられるRNAやDNAからなる核酸分子ですが、抗体のように標的分子を特異的に認識して強く結合することから、核酸抗体とよばれることがあります。自然界の核酸とタンパク質の相互作用に比べると、アプタマーとタンパク質の相互作用は非常に強いのですが、なぜアプタマーが標的タンパク質に強く結合できるのかは明らかになっていませんでした。
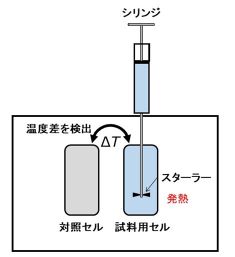
図1 等温滴定型熱量計の模式図。試料用セルに標的タンパク質を入れて、シリンジにアプタマーをセットする。数μLずつ滴定し、アプタマーと標的タンパク質の相互作用によって起こる発熱(吸熱の場合もある)を対照セルとの温度差として検出する。
■研究概要 アプタマーが標的タンパク質に強く結合できる理由は明らかにするため、アプタマーとタンパク質の立体構造を解析し、原子座標レベルで相互作用を明らかにすることを試みました。しかし、立体構造は揺らいでいることがわかり、立体構造を決定することは困難でした。そこで、等温滴定型熱量計を用いて熱力学的な視点から相互作用を解析しました(図1、文献1)。アプタマーと標的タンパク質が結合すると、大きな発熱があることがわかりました。これは、アプタマーと標的タンパク質の間に水素結合などの非共有結合が多く形成されたことを示しています。また、非常に揺らいでいるアプタマーが標的タンパク質と結合することによって、揺らぎが抑えられることも示唆されました。したがって、柔らかい構造のアプタマーが標的タンパク質の表面に沿うようにフィットして、多点的に相互作用していることが考えられました。これが、アプタマーが標的タンパク質に強く結合できる理由であると考えられました(文献2,3)。
■科学的・社会的意義 本研究は、アプタマーが標的タンパク質に強く結合できる理由を明らかにしましたが、この標的認識メカニズムはアプタマー医薬品を開発する際に役立つことが期待されます。
■参考文献
1)Amano, R., et al. (2016) “Kinetic and thermodynamic analyses of interaction between a high-affinity RNA aptamer and its target protein” Biochemistry, 55, 6221-6229.
2)Sakamoto, T., Ennifar, E., Nakamura, Y. (2018) “Thermodynamic study of aptamers binding to their target proteins” Biochimie, 145, 91-97.
3)Amano, R., Furukawa, T., Sakamoto, T. (2019) “ITC Measurement for High-Affinity Aptamers Binding to Their Target Proteins” Methods in Molecular Biology, 1964, 119-128.
■良く使用する材料・機器
1) 等温滴定型熱量計 (マルバーン)
2) 分子間相互作用解析装置 (サイティバ)
3) 核磁気共鳴分光計 (ブルカージャパン)
4) 安定同位体標識試薬 (大陽日酸)
 H25年度分野別専門委員
H25年度分野別専門委員
千葉工業大学・先進工学部・生命科学科
坂本泰一 (さかもとたいいち)
https://cit-lifescience.jp/sakamoto/index.html
