分子計測・微小操作
「ヌクレオソームを1分子ずつつかんで引っ張ることで、DNAのほどけ方を観察する」
■背景
生物の設計図であるDNAは、ヒストンという糸巻き状のタンパク質に巻き付いたヌクレオソームという形で細胞核内に収納されています。ヌクレオソームにいろいろなタンパク質がくっついたり、ヌクレオソーム同士が集合・解離したりすることで、この糸巻からのDNAのほどけやすさが細かく調節されて、生物は設計図のどの部分を読み出すのかを決めていると言われています。しかし、この詳細なメカニズムについては十分に分かっていません。
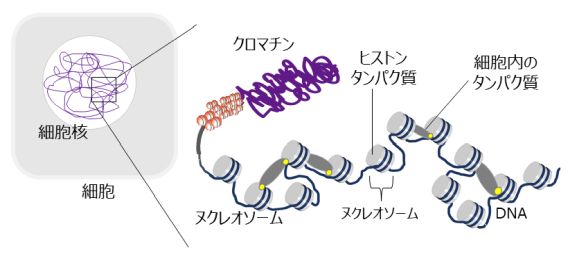
図1 ヌクレオソームに細胞内の別のタンパク質が結合したりすることで、遺伝情報(設計図)の読み出され方が調節される。
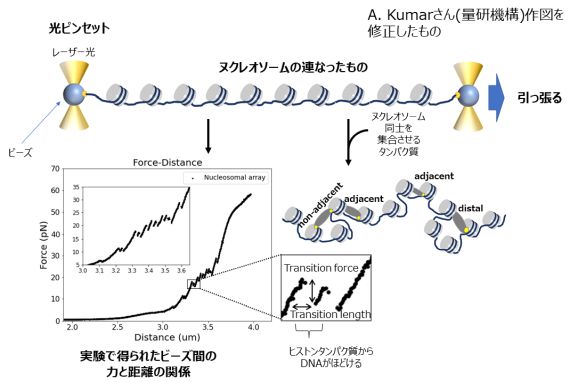
図2 DNA上にヌクレオソームをつないだものを作って、光ピンセットでつかんで引っ張りながら、DNA末端間の力と距離を測定したもの。この図の実験(左)では、ヌクレオソームを集合させるようなものを入れていないので、DNAはヌクレオソームからひとつずつ順に解けているが、ヌクレオソームを集合させるタンパク質を入れると、グラフの形が変化して、集合の状態を解析できる。
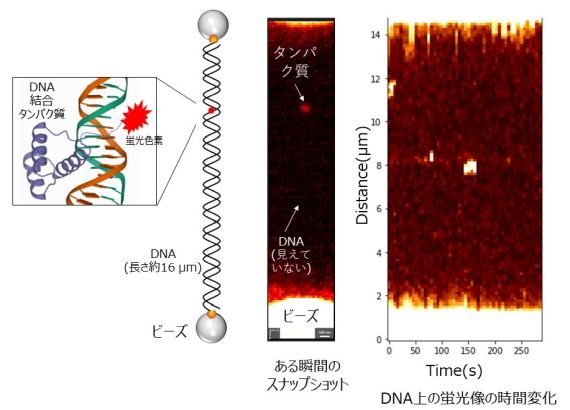
図3 DNA上のタンパク質の結合を蛍光顕微鏡で観察したもの。光っている点がDNAに蛍光タンパク質が結合していることを表している。蛍光像の時間変化から、タンパク質がDNAに結合したり解離したりしている様子がわかる。この方法を光ピンセットによる力の測定と組み合わせることで、ヌクレオソームへのタンパク質の結合とDNAのほどかれ方を同時に観察できる。
■研究概要
私たちは、研究の方法として、光ピンセット法という方法を用いています。この方法では、光が物質に照射されると、「光圧」というごく小さい力が物質に働く現象を利用します。これによって、強いレーザー光の焦点に透明なプラスチックのビーズを固定し、レーザー光の位置を動かすことによって、あたかも、光でできたピンセットを動かすかのようにビーズを動かすことができます。私たちは、長いDNAの真ん中に、ヌクレオソームを数珠状につないだものを作成し、2つのプラスチックビーズにDNAの両末端を固定しました。このビーズをすこしずつ引っ張ってヌクレオソームのDNAを引き剥がしながら、DNAがどのように剥がれていくのか、また、細胞内に存在する因子(イオンやタンパク質、薬剤など)を加えたときに、この剥がれ方がどのように変化するのかを調べることによって、ヌクレオソームのほどけやすさや集合の状態を調べています。
■科学的・社会的意義
生物の細胞内は静的な状態ではなく、細胞内のタンパク質がヌクレオソームに作用してDNAをほどくことでDNA上の遺伝情報の読み出しが行われています。この研究では、実際にヌクレオソームを一分子ずつずつつかんでほどいてみることで、実際の細胞内でのように、DNAがほどける過程で現れる様々な中間的な状態を観察することができます。そして、タンパク質など細胞内の因子が、これらの状態をどのように変化させているのかを明らかにできます。この研究を通じて、生物の遺伝情報の読み出し機構を分子のレベルで深く理解できるようになるとともに、抗がん剤など、ヌクレオソームに作用する薬剤の作用メカニズムが明らかになることが期待されます。
■参考文献
1) I. Heller, T.P. Hoekstra, G.A. King, E.J.G. Peterman, G.J.L. Wuite (2014) “Optical tweezers analysis of DNA-protein complexes. ” Chem Rev. 114: 3087-3119.
2) I. Heller, G. Sitters, O.D. Broekmans, G. Farge, C. Menges, W. Wende, S.W. Hell, E.J.G. Peterman, G.J.L. Wuite (2013) “STED nanoscopy combined with optical tweezers reveals protein dynamics on densely covered DNA.” Nature Methods 10: 910–916
■良く使用する材料・機器
1)光ピンセット装置 (Lumics社mTrap)
2)蛍光顕微鏡 (Abberior社 STEDYCON)
R4年度分野別専門委員
量研機構・量子生命科学研究所
角南智子 (すなみともこ)
https://www.qst.go.jp/site/iqls/
「2つの受容体分子がつくる会合体を、1つずつ直接観察し、正確に数える」
■背景 細胞膜上には、多種多様な受容体タンパク質が存在しています。近年、多くの受容体分子は、細胞膜上で異種・同種間の受容体と互いに結合しあうことで、2分子からなる会合体を作り、シグナルの制御や調整などを行なっているらしいことが分かりつつありますが、このような分子複合体の寿命や動態については詳しくわかっていません。

図1 GPCRの一つである、フォルミルペプチド受容体(本文参照)を細胞膜に発現させ、この受容体に特異的に結合する蛍光リガンドで受容体をラベルして得られた画像。細胞の一部を拡大して表示している。黄色い矢頭で示した単量体と、赤い矢印で示した二量体が同時に存在している。
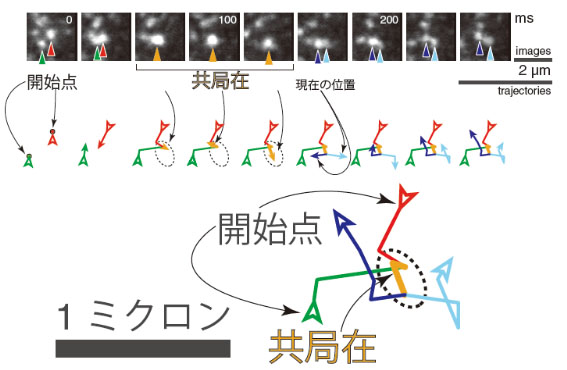
図2 蛍光リガンドでラベルしたフォルミルペプチド受容体が、細胞膜上で、動的かつ短寿命の二量体形成をする様子。このような受容体分子同士の結合・解離は、細胞膜上のいたるところで繰り返し起こっていた。

図3 本研究で決定した、フォルミルペプチド受容体の単量体・二量体平衡。
■研究概要 受容体分子が細胞膜上を拡散するようすを顕微鏡下で捉えるために、蛍光1分子観察法と呼ばれる方法を用います。これは、分子の運動や、うまく用いると分子の構造変化なども捉えることができるために、生物物理学の分野で大きな成果を上げている方法です。この方法を用いて、私の研究では、受容体1分子に対して、1つの蛍光色素分子で正確にラベルし、受容体1分子を直接かつ、定量的に観察しています。実際に、まず、Gタンパク質共役型受容体(GPCR)という、最大のタンパク質スーパーファミリーに属する、フォルミルペプチド受容体と呼ばれる受容体タンパク質を観察すると、生きている細胞の細胞膜の上で、これらの分子同士が結合と解離を繰り返していることがわかりました。こうした動的な結合解離の様子を実時間、場合によってはもっと高い時間分解能で調べ、GPCR同士の同種会合体の平衡についてまず詳しく調べて定量した後に、受容体の活性化に伴って、会合体はどのような振る舞いの変化を起こすのか、また、他の種類の受容体では、会合体の性質が異なるのか、などについて調べています。
■科学的・社会的意義 GPCRに属する受容体は、ヒトでは、7~800種類ある事が知られており、新薬開発の主要な標的分子としての研究も盛んに行われています。この研究を進めることで、GPCRのシグナル伝達における、シグナルの調整のしくみの一端が明らかになるだけでなく、副作用が少なく、効果の高い薬の開発に応用出来る可能性もあります。
■参考文献 Kasai RS, et al. (2011). "Full Characterization of GPCR Monomer-Dimer Dynamic Equilibrium by Single Molecule Imaging." J Cell Biol 192(3): 463-480.
■良く使用する材料・機器
1) 蛍光顕微鏡 IX-70(オリンパス株式会社)上にセットアップした、自作の対物レンズ型全反射蛍光顕微鏡
2) 蛍光色素の励起用レーザー (コヒレント・ジャパン、メレスグリオ株式会社等)
3) EB-CCDカメラ(電子打ち込み方式CCD) (浜松フォトニクス株式会社)
H24年度分野別専門委員
京都大学・再生医科学研究所
笠井倫志 (かさいりんし)
https://www.nanobio.frontier.kyoto-u.ac.jp/
