核酸構造
「核酸の構造単位:塩基対について − 個性豊かなミスマッチ塩基対達 −」
■背景
核酸(Nucleic Acid)とはDNA(Deoxyribonucleic Acid)およびRNA(Ribonucleic Acid)の総称です。核酸の化学構造上の構成単位はヌクレオチド(Nucleotide)と呼ばれ、リン酸基、糖部(リボース、又は、デオキシリボース)、核酸塩基(単に塩基ともいう)から構成されています(図1)。すなわちDNA及びRNAは、ヌクレオチドがリン酸基を介して連結したポリマー分子(Polynucleotide)です(図2)。
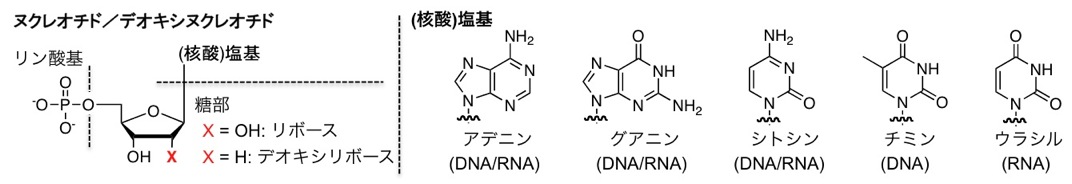
図1 ヌクレオチドおよび核酸塩基の化学構造。
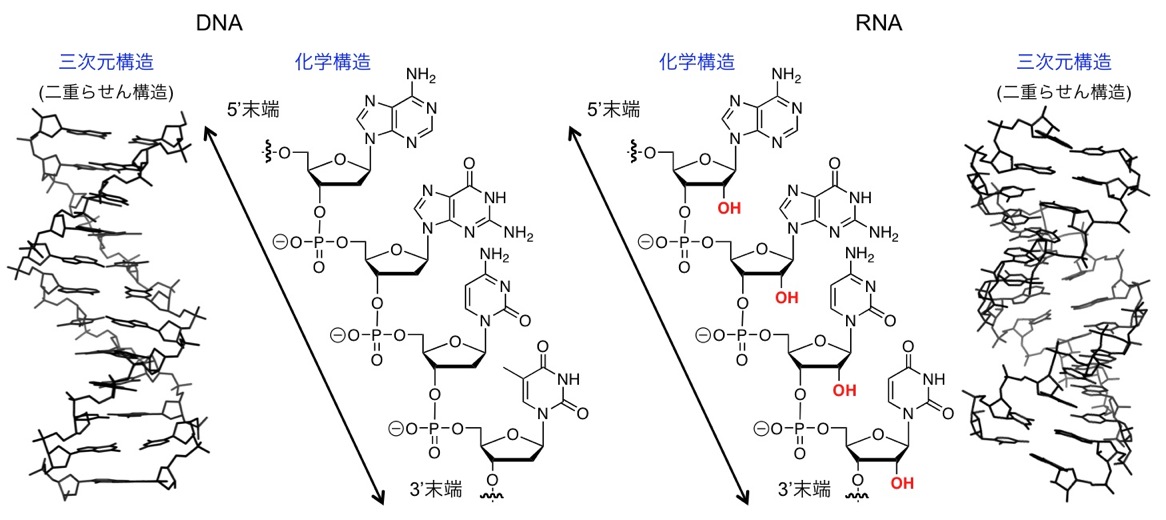
図2 DNAおよびRNAの化学構造と三次元構造(二重らせん構造)。DNAの三次元座標のPDB ID: 3BNA、RNAの三次元座標のPDB ID: 1RNA。
DNAとRNAの生体内における役割は、主に遺伝情報の保存と遺伝情報の発現(タンパク質への翻訳)の担い手/制御役です。このような特定の機能を担うためには、その機能を発揮するためにふさわしい構造をとっていることが必要です。例えばタイヤは円盤状の構造をしているから車輪としての機能を果たすことができます(四角いタイヤの車を想像してみてください)。ここで核酸分子に話を戻すと、「分子が構造を形成する」とはどういうことでしょう?
DNAやRNAのような生体高分子(ポリマー分子)が構造を形成するとは、その化学的骨格構造を維持したまま、特定の三次元構造に折りたたまることを指します。その際の最も基本になる三次元構造が二重らせん構造であり(図2)、その二重らせん構造の基本単位が塩基対と呼ばれるものです(図3)。DNAおよびRNA中において標準的に形成される塩基対を、その提唱者の名前にちなんで「ワトソン-クリック型塩基対」と呼びます。図3にあるようにワトソン-クリック型塩基対では、グアニン(G)とシトシン(C)、及び、アデニン(A)とチミン(T)がきれいに水素結合で対合し、それぞれG-C塩基対、A-T塩基対と呼ばれます(RNA中ではA-T塩基対ではなくA-U塩基対になる)。この核酸塩基同士の絶妙なマッチングが、遺伝情報の正確な伝達や遺伝子発現における情報伝達に大きく寄与しています。
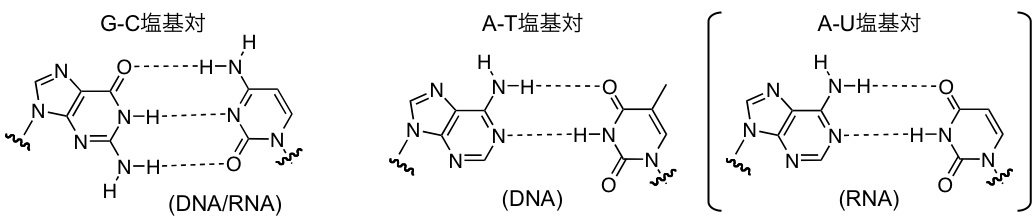
図3 DNAおよびRNA中のワトソン-クリック型塩基対。破線は水素結合を表す。
ところでDNAが生体内では基本的に二重らせん構造をとっているのに対して、RNA分子は一本鎖として発現されます。そのためRNA分子は全領域でワトソン-クリック型塩基対を組める訳ではありません。その結果、RNA二重らせん構造中では、ワトソン-クリック型塩基対を組めない塩基同士が向かい合うことがあり、このような部位をミスマッチと呼びます。このミスマッチとなった塩基は多くの場合、二重らせん構造中の前後の塩基対に挟まって(スタックして)存在しており、ミスマッチの塩基同士で対合していることが多々あります。このようなミスマッチ塩基同士の対合を、ワトソン-クリック型塩基対と区別して「ミスマッチ塩基対」と呼びます(図4)。
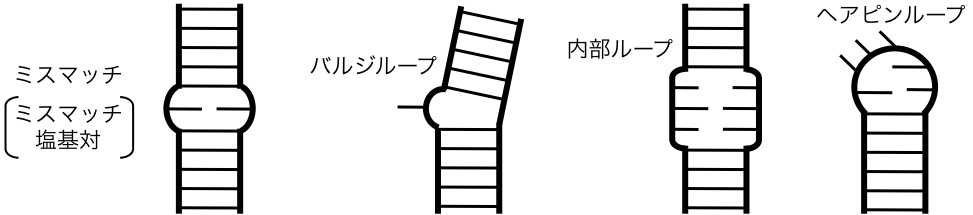
図4 RNA中の二次構造要素。太線がRNAの糖リン酸骨格(バックボーン)、細い線が核酸塩基または塩基対で、はしご状に見えるところが二重らせんを表す。
なおRNA分子は、翻訳過程における遺伝情報伝達や、タンパク質との相互作用を通じた生体制御、果ては酵素活性まで有する機能性生体高分子です。RNA分子がこれらの機能をはたすのに適した三次元構造を形成する際に、図4に示すミスマッチ塩基対をはじめとした種々の部分構造をとります。従ってRNA分子の機能発現機構を知るためには、三次元構造と、その構成要素であるミスマッチ塩基対の構造および物性(分子の物理的性質)を深く知る必要があります。
■研究概要
このような背景から、RNA分子の水溶液中の三次元構造や、RNA分子の機能発現と関わる物性などを、NMR分光法により決定しています。これまでに我々の研究室で構造決定を行ったミスマッチ塩基対としては、G-U、C-Uミスマッチ塩基対があります(図5)(文献1,2)。
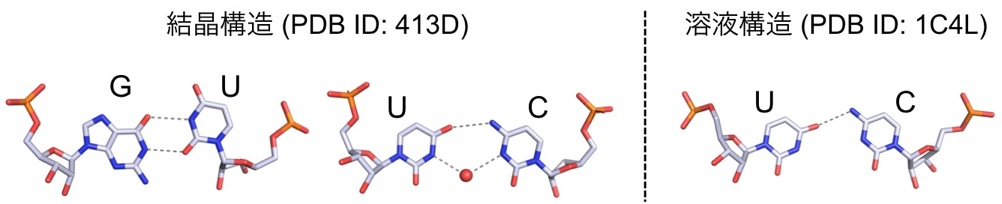
図5 G-Uミスマッチ塩基対とC-Uミスマッチ塩基対。破線左側の構造は結晶構造(PDB ID: 413D)中のミスマッチ塩基対。右側の構造は溶液内の構造(PDB ID: 1C4L)中のミスマッチ塩基対。白: 炭素原子、赤: 酸素原子、青: 窒素原子、オレンジ: リン原子。結晶構造中のC-U塩基対の間に存在する赤丸は水分子の酸素原子。破線は水素結合。
物性研究としては、G-Aミスマッチ塩基対を含む金属イオン結合モチーフと金属イオンの相互作用解析があります。G-Aミスマッチ塩基対は隣接する塩基配列の影響を受けて複数の塩基対様式をとることが知られています。そのうちsheared型G-A塩基対はRNA分子中の機能性モジュールの形成に深く関与しています(図6)。具体的な役割としては、1) 熱安定性の高いヘアピンループ構造の形成(文献3)、2) 金属イオン結合モチーフの形成(文献4)、3) 酵素活性を有したRNA分子(Ribozyme: Ribonucleic Acid Enzyme)の触媒中心の形成(文献5)等があります。我々の研究室では、結晶構造から示唆された金属イオン結合モチーフ(図6)が、溶液中でも金属イオンを結合(保持)できることをNMR分光法により証明しました(文献6)。
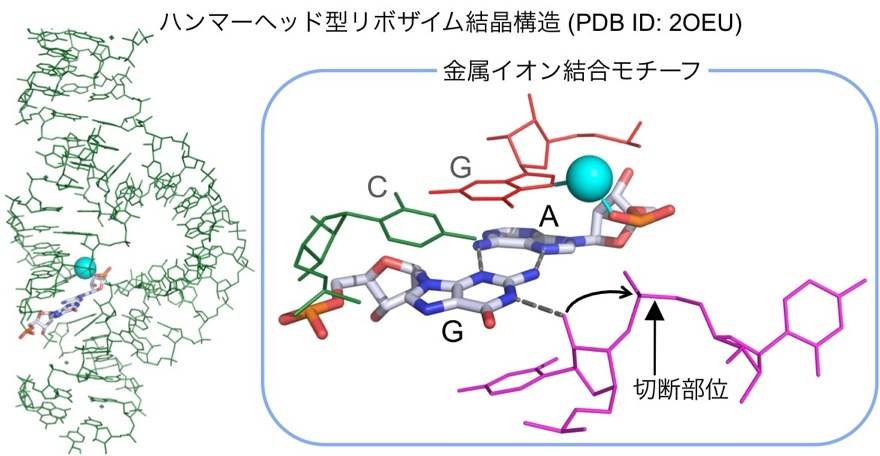
図6 ハンマーヘッド型リボザイムの結晶構造(PDB ID: 2OEU)と金属イオン結合モチーフの拡大図。水色の球は金属イオン。破線は水素結合。G-Aミスマッチ塩基対の色の定義は図5の脚注参照。他の隣接塩基についてはワイヤーモデルで表示。
このようにミスマッチ塩基対は、比較的均質な構造である二重らせん構造の中に変化をもたらし、活性発現に適した三次元構造を形成するのに役立っています。さらに機能面では、核酸の機能を補足してくれる金属イオンの保持や、直接的に触媒中心を形成して、生体内の化学反応を促進にも関与しています。
■科学的・社会的意義
本研究は、生体内ではたらいているRNA分子がどのような機構で機能を発現しているかを構造の観点から明らかにすることにつながります。また構造と機能の関係が明らかになることで、機能性RNA分子を医薬品とすることも可能となります。最後に出てきた酵素活性有したRNA分子 "Ribozyme" は、RNA分子の切断能を有していることから遺伝子治療薬への応用も期待されている分子です。変異を起こした遺伝子にもとづくmRNA中には誤った配列が含まれていますが、Ribozymeによる遺伝子治療では、この誤った塩基配列を狙い撃ちして切断することが期待されています。今後のRNA創薬に期待がもたれるところです。
■参考文献
1)Tanaka, Y., Fujii, S., Hiroaki, H., Sakata, T., Tanaka, T., Uesugi, S., Tomita, K. and Kyogoku, Y. (1999) "A'-form RNA double helix in the single crystal structure of r(UGAGCUUCGGCUC)." Nucleic Acids Res., 27(4):949-955.
2)Tanaka, Y., Kojima, C., Yamazaki, T., Kodama, T. S., Yasuno, K. Miyashita, S. Ono, A., Ono, A., Kainosho, M. and Kyogoku, Y. (2000) "Solution structure of an RNA duplex including a C-U base-pair." Biochemistry, 39(24):7074-7080.
3)Heus H. A. and Pardi A. (1991) "Structural features that give rise to the unusual stability of RNA hairpins containing GNRA loops." Science(5016). 253:191-194.
4)Pley, H. W., Flaherty, K. M. and McKay, D. B. (1994) "Three-dimensional structure of a hammerhead ribozyme." Nature(6501), 372, 68-74.
5)Martick M. and Scott W. G. (2006) "Tertiary contacts distant from the active site prime a ribozyme for catalysis." Cell, 126(2);309-320.
6)Tanaka, Y., Kojima, C., Morita, E. H., Kasai, Y. Yamasaki, K. Ono, A. Kainosho, M., and Taira, K. (2002) "Identification of the metal ion binding site on an RNA motif from hammerhead ribozyme using 15N-NMR spectroscopy." J. Am. Chem. Soc., 124(17), 4595-4601.
■良く使用する材料・機器
1) NMR分光器(ブルカーバイオスピン株式会社、日本電子株式会社)
2) UV分光器、CD分光器 (日本分光株式会社)
3) DNA/RNA合成機 (Applied Biosystem社、日本テクノサービス株式会社)
 H29年度分野別専門委員
H29年度分野別専門委員
徳島文理大学・薬学部
田中好幸 (たなかよしゆき)
https://p.bunri-u.ac.jp/lab05/index.html
「RNAの構造と働き」
■背景
核酸には、DNAとRNAがあり、塩基と糖とリン酸が結合したヌクレオチドを構成成分としています。DNAの場合は、アデニン(A)、グアニン(G)、シトシン(C)、チミン(T)という4種類の塩基とデオキシリボースという糖により、RNAの場合は、A、G、Cとウラシル(U)という4種類の塩基とリボースという糖により構成されています。ワトソンとクリックらによって明らかになったDNAの二重らせん構造(図1B)は有名ですが、RNAもDNAと同様に二重らせん構造(図1A)も形成します。
様々な生物のゲノムが解読されると、多くの機能性RNA(Non-coding RNAという)が見つかってきています。RNAは、二重らせん構造だけではなく、様々な立体構造を形成して、様々な働きをしていることが明らかになっています。生命現象において、RNAが重要な役割を担っているのです。また、進化分子工学の手法を用いて、標的とする物質に強く結合するような人工のRNA(アプタマーという)を作製することも可能になっています。
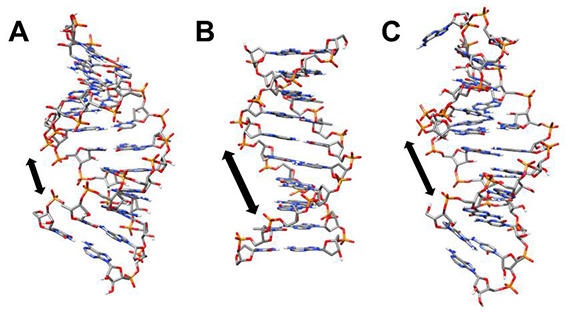
図1 核酸の構造
RNAのA型二重らせん構造(A)、DNAのB型二重らせん構造、RNAアプタマーの立体構造(C)(PDB ID: 2RRC)。RNAの二重らせん構造の主溝は、DNAのものより狭く、タンパク質は主溝に結合できません。RNAアプタマーには、非ワトソン・クリック型の塩基対があるため、らせん構造に歪みが生じて主溝が広がり、タンパク質が結合できるようになっています。
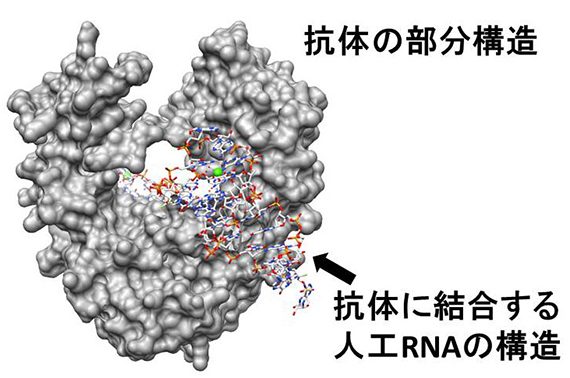
図2 抗体に結合するRNAアプタマーの立体構造(PDB ID: 3AGV)
医薬品となる抗体が開発されていますが、このRNAアプタマーは、抗体を特異的に認識して強く結合するので、抗体医薬品の分離精製のために使うことができます。
■研究概要
様々な働きを担うRNAの立体構造を明らかにすることによって、RNAがどのようなメカニズムで働いているか明らかにすることができます。例えば、図1CのRNAアプタマーは、急性骨髄性白血病の治療のために作られましたが、病気の原因となっているDNA結合タンパク質に、DNAの構造を擬態して結合していることが明らかになりました。図2のRNAアプタマーは、抗体に結合しますが、抗体の分子表面に形を合わせることによって、非常に強く結合することがわかりました。
■科学的・社会的意義
本研究では、RNAがどのような立体構造でどのように働くのかを解明することにより、生命現象におけるRNAの働きを原子のレベルで物理化学的に明らかにします。RNAアプタマーは、次世代型の医薬品として期待されているので、RNA医薬品の開発にも貢献します。
■参考文献
1)Nomura, Y., et al. (2010). “Conformational plasticity of RNA for target recognition as revealed by the 2.15 Å crystal structure of a human IgG-aptamer complex.” Nucleic Acids Res. 38(21): 7822-7829.
2)Nomura, Y., et al. (2013). “Solution structure of a DNA mimicking motif of an RNA aptamer against transcription factor AML1 Runt domain.” J. Biochem. 154(6): 513-519.
■良く使用する材料・機器
1) 核磁気共鳴分光計 (ブルカー・バイオスピン株式会社)
2) 安定同位体標識試薬 (大陽日酸株式会社)
 H27年度分野別専門委員
H27年度分野別専門委員
千葉工業大学・工学部
坂本泰一 (さかもとたいいち)
https://www.le.it-chiba.ac.jp/sakamoto/index.html










