核酸結合タンパク質
「機能・構造を変幻させる核酸結合タンパク質HMGB1」
■背景
タンパク質の構造と機能には相関があります.多くのタンパク質の立体構造は,特定の機能をになうために最適化されています.安定な立体構造を保持したタンパク質の構造と機能の相関は良く研究されてきており,タンパク質の「構造-機能相関」という概念ができています.しかし,タンパク質が様々な化学修飾をうけ,さらに環境に応じて構造変化することで全く異なる機能を示すこともあります.
細胞核内で遺伝情報制御に関与する核酸結合タンパク質として見つかったHMGB1タンパク質は,細胞間では,化学修飾を受けて信号伝達という全く異なる機能をもつことが分かってきました.HMGB1は,遺伝情報制御の過程でもタンパク質全体の構造を大きく変化させて機能します.一方,細胞外のHMGB1は,その中に含まれる高い化学的反応性をもつシステイン残基の酸化・還元状態に応じて,異なる信号を伝達する分子として働きます.HMGB1は,変幻自在に立体構造・化学構造を変化させて多様な機能を実現します.
HMGB1のようにタンパク質の多様な構造変化と機能が,どのような化学的・物理的性質の変化によって実現されるかを解明することが生物物理学の研究対象となります.
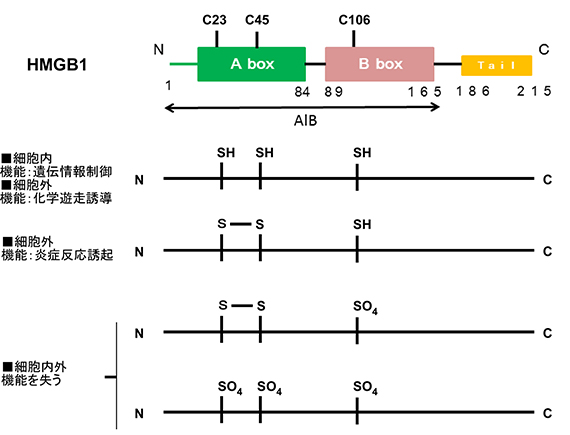
図1: HMGB1タンパク質は,2つのHMG boxと呼ばれる構造部(A, B boxで示される)と酸性残基を多く含む部分(Tailと示される)が安定な構造を持たないポリペプチド鎖でむすばれて一つのタンパク質を構成する.HMGB1中にある3つのシステイン残基は,細胞内では還元状態でチオール(SH)を持つが,細胞外では酸化され,C23-C45でジスルフィド結合あるいはスルホン酸をもつ.それぞれの状態で,細胞内外での機能が変化する.
■研究概要
HMGB1タンパク質の化学修飾による構造変化は,安定な構造部であるA-boxあるいはB-boxの静的な立体構造変化を伴います.核磁気共鳴分光法(NMR)を用いて,化学修飾に伴うタンパク質の構造変化を高精度に解析できます.A-box中のC23-C45の間でジスルフィド結合が形成されることで,A-box中のDNAとの相互作用に関与する領域付近に明瞭な変化が観測されました.この構造解析から,酸化反応で生じるC23-C45ジスルフィド結合によるHMGB1の機能変化が説明できました.
HMGB1は,安定な立体構造をもつA, B-boxが,特定の構造を持たないポリペプチド鎖でつながれています.この2つの構造部が,溶液中でどのように配置しているかは細胞表層にある受容体によるHMGB1認識過程を知る上では重要です.NMRを用いることで,2つの構造部の溶液中での相対的な配置を知ることもできます.A, B-boxの相対的配置は,溶液中では一つの位置に固定されたものではなく,だからといって無秩序にばらばらな配置を取っているわけでもありません.2つのbox構造部は,特定の配置を中心として揺動する動的な構造を持ちます.安定に1つの構造を保持する静的構造だけではなく,動的な構造の特性をも知ることができるのがNMRを使ったタンパク質構造解析の特徴です.
核酸結合タンパク質HMGB1を例として示しましたが,化学修飾による静的な構造変化や,柔軟なポリペプチド鎖を含むタンパク質の動的な構造の解析は,通常のタンパク質「構造-機能相関」の枠組みでは捉えきれない様々なタンパク質の研究で重要になります.
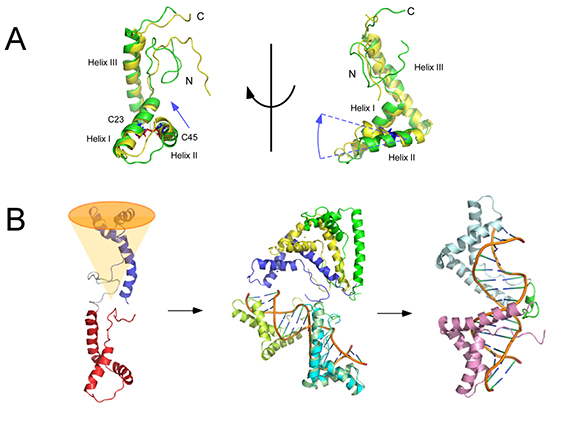
図2:(A)ジスルフィド結合によるHMGB1 A-boxの構造変化.還元条件での構造は黄色,C23-C45でジスルフィド結合をもつ構造を黄色で示す.(B)A, B-boxの溶液中の空間配置の解析例.A, B-boxは,溶液中でランダムに配置するのではなく,図の構造を中心としてオレンジ色のコーンで示した範囲に主として存在する.DNAに結合する過程では,2つのbox部の配置は,揺動しながらも少しずつ変化することがNMRにより明らかになった.
■科学的・社会的意義 HMGB1は,重篤な炎症反応を誘導することが知られています.しかし,その構造多様性ゆえに,細胞表層にある受容体へのHMGB1の結合を介した炎症応答の分子機構は未だに理解されていません.HMGB1に限らず,化学修飾等を通して変幻自在に構造を変えるタンパク質を対象とした研究には,従来までの安定な構造をもつタンパク質の研究とは異なる研究のアプローチが必要になります.新たなタンパク質構造研究手法を開発して,例えばHMGB1による炎症反応を抑制するような創薬研究へつなげることが期待できます.
■参考文献
| 1) | Wang,J., Tochio,N., Takeuchi,A., Uewaki,J., Kobayashi,N., and Tate,S. "Redox-sensitive structural change in the A-domain of HMGB1 and its implication for the binding to cisplatin modified DNA" BbrC, 441, 701-706 (2013). |
| 2) | Uewaki,J., Kamikubo,H., Kurita,J., Hiroguchi,N., Moriuchi,H., Yoshida,M., Kataoka,M., Utsunomiya-Tate,N., and Tate,S. "Preferential domain orientation of HMGB2 determiend by the weak intramolecular interactions mediated by the interdomain linker" Chem. Phys., 419, 212-223 (2013). |
| 3) | Tjandra,N., Tate,S., Ono,A., Kainosho,M., and Bax,A.”The NMR structure of a DNA dodecamer in an aqueous dilute liquid crystalline phase” J.Am.Chem.Soc. (2000), 122, 6190-6200. |
| 4) | Yang,H., Antonie,D.J., Anderson,U., and Tracey,K.J. “The many faces of HMGB1: molecular structure-functional activity in inflammation, apoptosis, and chemotaxis” J. Leukocyte Biol. 93, 865-873 (2013). |
■良く使用する材料・機器
1) 安定同位体標識化合物 (SIサイエンス株式会社)
2) 実験試薬 (和光純薬株式会社)
3) NMR分光器 (ブルカー・バイオスピン株式会社)
 H27年度分野別専門委員
H27年度分野別専門委員
広島大学大学院理学研究科
楯 真一 (たて しんいち)
http://www.mls.sci.hiroshima-u.ac.jp/biophys/index.html
