細胞骨格
「細胞骨格が生み出す力はどのように伝達されるか」
■背景
アクチン細胞骨格は、筋肉のアクチンとミオシンによる収縮がよく知られていますが、筋肉だけではなく全ての真核細胞に存在し、細胞内で力を発生する主要な構造です。アクチン細胞骨格の材料となるアクチンフィラメントは、単量体アクチンが集まって(「アクチン重合」と呼びます)、形成されます。アクチン細胞骨格は、アクチン重合、または、ミオシンモータータンパク質との相互作用により“力”を発生します。アクチン細胞骨格の生み出す力は、細胞運動や細胞分裂の動力となります(文献1)。
アクチン細胞骨格の発生する力は、接着斑 (focal adhesion) と呼ばれる接着装置を介して細胞外の足場に伝達されます(図1)。接着斑では、アクチンフィラメントと接着タンパク質インテグリンの間を多様なタンパク質が架橋します(文献2)。アクチン細胞骨格は力を発生しながら動き続けるダイナミックな構造体であり、アクチン構造の動力を接着装置がどのように細胞外の足場に伝達するのかは不明な点が多く残っています。

図1 細胞は、接着斑を介してアクチン細胞骨格と細胞外の足場(基質)を連結する(模式図)。写真は、培養上皮細胞での接着斑タンパク質(パキシリン)とアクチン繊維の局在を示す。
■研究概要
私達は、細胞内蛍光1分子イメージングにより、アクチンとインテグリンを架橋する接着斑タンパク質を直接可視化し、分子レベルでの力伝達メカニズムを明らかにしてきています。これまで、主要な架橋タンパク質であるタリン (talin) が、アクチンに引っ張られてタンパク質の一部がほどける(メカニカル・アンフォールドする)ことで、アクチンと足場の間を連結し力を伝達することを明らかにしました(図2左、文献3)。
生命科学の分野では一般的に、接着斑タンパク質は静的な結合によりアクチンを細胞足場に繋ぎ留めていると考えられています。一方、私達は細胞内1分子イメージングにより接着斑タンパク質の動的な挙動を見出しています。これまでの概念を覆す接着斑タンパク質のダイナミックな“ふるまい”から、力伝達機構の解明に取り組んでいます。
私達はまた、蛍光標識アクチンをエレクトロポレーションで細胞内に導入することで、高効率・簡便であるとともに、時空間分解能が大幅に向上した電気穿孔法利用型単分子スペックル (eSiMS) 顕微鏡法を開発しました(図2右、文献4)。この手法を活用して、細胞内外の力に対するアクチン細胞骨格の応答をアクチン1分子イメージングにより明らかにしています(文献5、6)。

図2 左:細胞内タリン蛍光1分子イメージングの観察例。右:接着斑(緑、ビンキュリンで標識)と蛍光アクチン単分子イメージング(赤)の同時観察例。
■科学的・社会的意義 アクチン細胞骨格の発生する力は、細胞の移動や形態制御などの基本的な細胞現象を駆動する重要な動力です。力の伝達機構と役割を明らかにすることは、細胞活動の仕組みの根本的な理解に繋がります。また、1分子イメージングの解像度でタンパク質の挙動を可視化・計測することによって初めて解明できる課題があります。
■参考文献
1)Svitkina, T. (2018). "The actin cytoskeleton and actin-based motility." Cold Spring Harb Perspect Biol 10 (1): a018267.
2)Kanchanawong, P. and Calderwood, D.A. (2023). "Organization, dynamics and mechanoregulation of integrin-mediated cell-ECM adhesions." Nat Rev Mol Cell Biol 24: 142-161.
3)Yamashiro, S., Rutkowski, D.M., et al. (2023). "Force transmission by retrograde actin flow-induced dynamic molecular stretching of Talin." Nat Commun 14(1): 8468.
4)Yamashiro, S., Mizuno, H., et al. (2014). "New single-molecule speckle microscopy reveals modification of the retrograde actin flow by focal adhesions at nanometer scales." Mol Biol Cell 25(7): 1010-1024.
5)Mizuno, H., Tanaka, K., et al. (2018). "Helical rotation of the diaphanous-related formin mDia1 generates actin filaments resistant to cofilin." Proc Natl Acad Sci USA. 115(22): E5000-E5007.
6)Yamashiro, S., Tanaka, S., et al. (2018). "RMyosin-dependent actin stabilization as revealed by single-molecule imaging of actin turnover." Mol Biol Cell 29(16): 1941-1947.
■良く使用する材料・機器
1) 蛍光顕微鏡システム IX83 (株式会社エビデント)
2) EMCCDカメラ iXon Ultra(Andor社)
3) 動物培養細胞
 2025年度分野別専門委員
2025年度分野別専門委員
京都大学大学院生命科学研究科 分子動態生理学分野
山城 佐和子 (やましろ さわこ)
https://researchmap.jp/7000010388
「細胞の“力”と細胞骨格の様子からアメーバ運動の仕組みに迫る」
■背景
細胞のアメーバ運動は原生生物アメーバから神経組織の形成にまで見られる普遍的な機能です。細胞はアメーバ運動するための前後を自分で決められるし(図1A)、基質に接着さえすれば必ず決まったかたちになって運動する細胞までいます(図1B)。前後極性やかたちの自律的な形成という生物の特徴は細胞ひとつにも存在するのです。細胞はどうやってアメーバ運動のための前後極性はかたちをつくっているのでしょう?
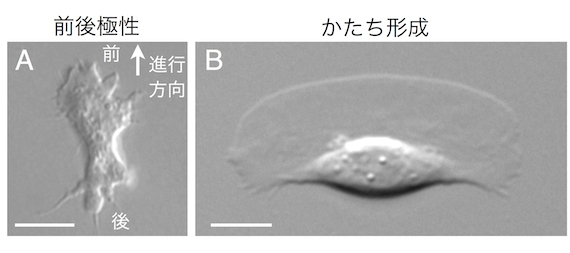
図1 A:細胞性粘菌アメーバDictyostelium discoideum。B:魚類表皮細胞keratocyte。
アメーバ運動しているkeratocyteは、進行方向前方に大きな葉状仮足が広がった三日月形の形状を維持する。 Bars = 5 µm。
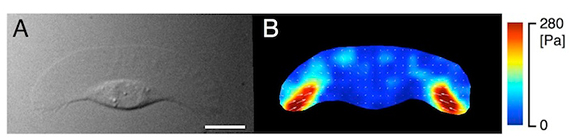
図2 アメーバ運動しているkeratocyte が基質に発揮する牽引力。微分干渉像(A)、疑似カラー表示された牽引力(B)。 Bar = 5 µm。
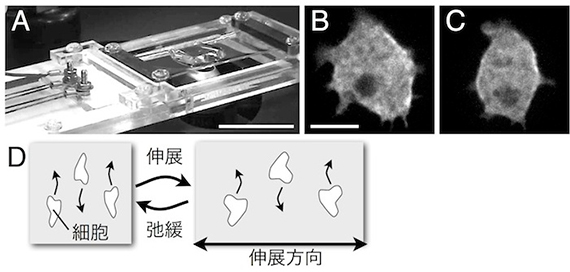
図3 繰り返し基質伸展による細胞骨格動態とアメーバ運動の制御。A:繰返し基質伸展装置。シリコーン製の基質表面に細胞を接着させる。 Bar = 3 cm。B, C:繰返し基質伸展による細胞性粘菌アメーバのミオシンⅡの伸展両側への集積。伸展前(B)、伸展後(C)。 Bar = 5 µm。D:細胞性粘菌アメーバや好中球様 HL-60株は繰返し基質伸展刺激により、伸展と垂直に運動する。
■研究概要 アメーバ運動は、細胞骨格が発揮する“力”無しには成り立ちません。私たちは、アメーバ運動している細胞が発揮する牽引力を計測したり(図2、文献1)、あるいは、細胞に人為的に“力”を加えたときの細胞骨格の振舞いやアメーバ運動の変化を光学顕微鏡で観察することで、この疑問に答えようとしています。例えば、細胞を伸縮性のある基質に接着させ、基質を繰返し伸展させると(図3A)、細胞は伸展両側にミオシンⅡという細胞骨格分子を集積させ(図3B、文献2)、伸展方向とは垂直にアメーバ運動することを、私たちは明らかにしました(図3C)。
■科学的・社会的意義 私たちの研究は、アメーバ運動の根本的なメカニズムがどのような物理(力学)法則に従っているのかを解明することに繋がるでしょう。さらに、私たちの研究によって、細胞のアメーバ運動を人為的な“力”負荷で制御することができるようになれば、がん細胞や好中球の誘導など画期的な医療応用のヒントになるかもしれません。
■参考文献
1)Iwadate, Y., et al. (2013). Myosin-II-mediated directional migration of Dictyostelium cells in response to cyclic stretching of substratum. Biophys J 104: 748-758.
2)Iwadate, Y., et al. (2008). Actin-based propulsive force and myosin II-based contractile force in a migrating Dictyostelium cells. J Cell Sci 121: 1314-1324.
■よく使用する材料・機器
1)倒立顕微鏡システムTi-E(株式会社ニコンインステック)
2)共焦点ユニットCSU-X1(横河電機株式会社)
3)CCDカメラ iXon DU-897(アンドール・テクノロジーLtd)
4)光学部品(シグマ光機株式会社)
 H27年度分野別専門員
H27年度分野別専門員
山口大学大学院・医学系研究科
岩楯好昭(いわだてよしあき)
https://cellsystem.sci.yamaguchi-u.ac.jp/
「アクチン繊維は、どのようにして多種多様な機能を果たすのか」
■背景
細胞骨格は、タンパク質が重合して形成された細胞内の繊維状構造の総称で、真核細胞の場合は、繊維の太さによって、アクチン繊維(ミクロフィラメントともいう)、微小管、中間径繊維の3種類に大別されます。このうち、アクチンとよばれるタンパク質が重合したアクチン繊維と、チュブリンとよばれるタンパク質が重合した微小管は、酵母から高等動植物に至る全ての真核細胞に存在し、真核細胞にとって非常に重要な働きをしています。実際に、細胞内のアクチン繊維や微小管を観察してみると、それぞれ特徴的なパターンをもって細胞内に張り巡らされたネットワークを形成しています。
それでは、細胞骨格は具体的にどのような機能を果たしているのでしょうか。「骨格」という言葉からイメージされるように、細胞の形態を力学的にサポートするといった静的な機能が想定されているケースもありますが、重合する力で細胞を変形させたり(例:仮足の伸長)、モータータンパク質と相互作用して収縮を引き起こしたり(例:ミオシンとの相互作用に基づく筋収縮や細胞質分裂)、電車のレールのように細胞内物質輸送の足場となったり(例:神経軸索中の膜胞の輸送や染色体の分離)、細胞と外部との接着に関与するなど、様々な動的プロセスでも中心的な役割を果たしています。
図1に示した模式図は右向きに運動しているアメーバ細胞ですが、前部では、アクチン繊維の重合が仮足の前端を前に押し出しています。後部では、アクチン繊維はミオシンと相互作用し、収縮を引き起こすことで前進運動に貢献します。同時に、細胞は基質との接着点で力を伝達しますが、そうした接着構造にもアクチン繊維は関与します。そのほか、細胞内での膜胞輸送や、遺伝子の発現制御にもアクチンが関与しています。これらの現象は、同一細胞内で同時に進行するのですが、それでは、アクチン繊維は、どのようにして、同一細胞内で同時に異なる機能を果たすのでしょうか。一般には、ミオシンやコフィリンといった様々なアクチン結合タンパク質の活性が細胞内のそれぞれの場所で異なる生化学的な制御を受けているためだろうと考えられていますが、それだけでは説明の難しい現象も多く、この問題は、細胞生物学の大きな謎となっています。
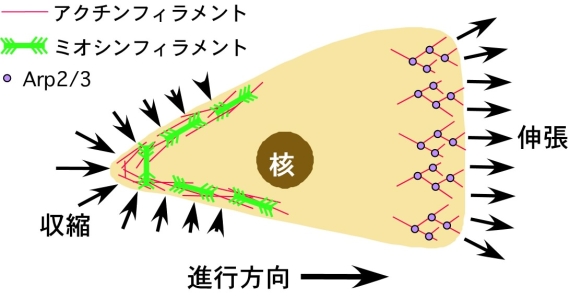
図1 アメーバ細胞の模式図。前部では、Arp2/3とよばれるタンパク質が前側に向かってアクチン繊維の重合をひきおこし、その結果、細胞膜が前側に押し出されます(この領域を仮足とよびます)。一方後部では、アクチン繊維とミオシン繊維が相互作用し、収縮力を発生します。これにより細胞後部が前方向に引き込まれていきます。この図では、膜胞輸送や基質との接着、遺伝子の発現制御に関与するアクチン繊維は示していません。
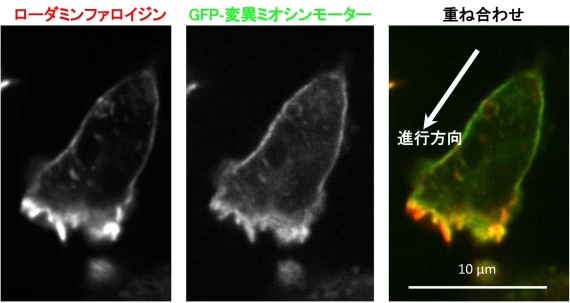
図2 運動中の細胞性粘菌アメーバの蛍光顕微鏡写真。ローダミンファロイジン(左)は、細胞中のアクチン繊維を均一に染める赤色蛍光色素で、GFP-変異ミオシンモーター(中央)は、ミオシンと結合しやすいアクチン繊維を選択的に緑色に染めます。ローダミンファロイジンとGFP-変異ミオシンモーターの染色パターンは似ていますが、重ね合わせてみると(右)、細胞の横と後部のアクチン繊維はミオシンと結合しやすいことが分かります。これらの領域は、アクチン繊維とミオシンが相互作用して収縮力を発生し(図1)、アクチン繊維に張力がかかっていると思われるところです。
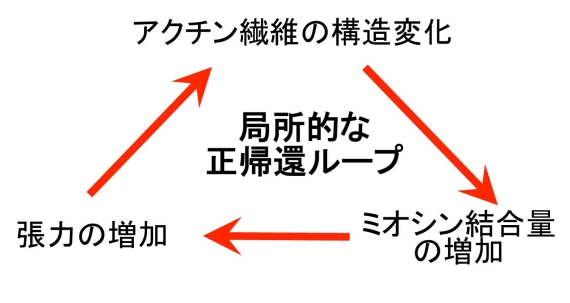
図3 アクチン繊維の構造変化を介した正帰還ループの概念図。こうしたループは、外界からの力学的刺激による張力増加や、生化学的シグナルによるミオシンの活性化、あるいは熱揺らぎによりトリガーされ得ます。図1のアメーバ細胞の後部では、こうしたループが確立し、後部を安定化させていると考えています。
■研究概要
アクチン繊維は、アクチンが二重らせん状に重合した繊維ですが、近年、主としてわが国の電子顕微鏡研究者の貢献により、その詳細な構造が分かってきています(1,2)。これらの成果を見ると、アクチン繊維はいかにも特定の構造をとっているように思えてきますが、実はアクチン繊維には複数の異なる構造があり、それらが平衡の関係にあると考える研究者もいます(3)。そこでわれわれは、アクチン繊維を引っ張るとバネのように伸びて構造が変化し、それによって様々なアクチン結合タンパク質との親和性が強くなったり弱くなったりするのではないかという仮説をたてました。
そこでこの仮説を検証するため、細胞内のさまざまなアクチン繊維とミオシンとの親和性を調べたところ、張力がかかっていると思われるアクチン繊維にはミオシンがよく結合し、逆に張力がかかっていないと思われるアクチン繊維はミオシンと相互作用しにくいことが分かりました(図2)(4)。ミオシンはアクチン繊維と相互作用して張力を発生するので、ミオシンと相互作用しているアクチンは張力によって構造が変化し、その結果ミオシンとの相互作用が強まるなら、ミオシンとアクチン繊維の相互作用は、張力発生とそれによる構造変化を介した正帰還ループを形成し、収縮性の状態を安定化することになります(図3)。一方名古屋大学の曽我部らは、アクチン繊維を特殊な装置で引っ張ると、コフィリンとの親和性が弱まることを見出しています(5)。これらの結果は、張力を介した構造変化がアクチン繊維の機能を規定している例と考えられますが、最近は、そのほかにも様々な要因でアクチン繊維の構造は変化することが分かってきています。したがってわれわれは、アクチン繊維は様々な異なった構造をとることができ、それがアクチン繊維の多様な機能を決める一因になっているのではないかと考え、さらに研究を進めています。
■科学的・社会的意義 本研究は、ヒトを含む真核細胞にとってもっとも重要なタンパク質のひとつであるアクチンの機能がどのように規定されているかを理解するうえで新たな視点を提供することになります。またアクチンの変異はさまざまな遺伝病の原因となることが知られているので、アクチンの構造に影響を与えるような化合物を探すことができれば、新たな創薬につなげることもできるかもしれません。
■参考文献
1. Fujii, T., Iwane, A. H., Yanagida, T., and Namba, K. (2010) Direct visualization of secondary structures of F-actin by electron cryomicroscopy. Nature 467, 724-728
2. Murakami, K., Yasunaga, T., Noguchi, T. Q., Gomibuchi, Y., Ngo, K. X., Uyeda, T. Q. P., and Wakabayashi, T. (2010) Structural basis for actin assembly, activation of ATP hydrolysis, and delayed phosphate release. Cell 143, 275-287
3. Galkin, V. E., Orlova, A., Schroder, G. F., and Egelman, E. H. (2010) Structural polymorphism in F-actin. Nat. Struct. Mol. Biol. 17, 1318-1323
4. Uyeda, T. Q. P., Iwadate, Y., Umeki, N., Nagasaki, A., and Yumura, S. (2011) Stretching actin filaments within cells enhances their affinity for the myosin II motor domain. PLoS One 6, e26200
5. Hayakawa, K., Tatsumi, H., and Sokabe, M. (2011) Actin filaments function as a tension sensor by tension dependent binding of cofilin to the filament. . J. Cell Biol. 195, 721-727
■良く使用する材料・機器
1) 蛍光顕微鏡システム (オリンパスIX-71 + 横河CSU-10共焦点ユニット)
2) 実験試薬 (和光純薬株式会社など)
3) 冷却CCDカメラ オルカER (浜松ホトニクス株式会社)
H24年度分野別専門委員
産業技術総合研究所・バイオメディカル研究部門
上田太郎 (うえだたろう)
https://www.qp.phys.waseda.ac.jp/index.html
