脂質膜・生体膜
「戦場となる膜」
■背景
全ての生物、全ての細胞は、細胞膜・生体膜に覆われて外界から区画されることで、その恒常性を保ち機能を維持しています。
だからこそ、膜を可溶化して破壊したり膜に穴を開けたり(膜穿孔)する物質は、病原体が宿主の細胞に感染する際に利用する毒素(文献1)にも成り得れば、逆に病原体を殺して防ぐための抗菌物質(文献2)にも成り得ます。例えば、抗体と協力して免疫に働く補体(complement)と呼ばれる蛋白質群も、最終的には病原体の細胞膜に穴を開けて壊すことで生体防御に関わっています。
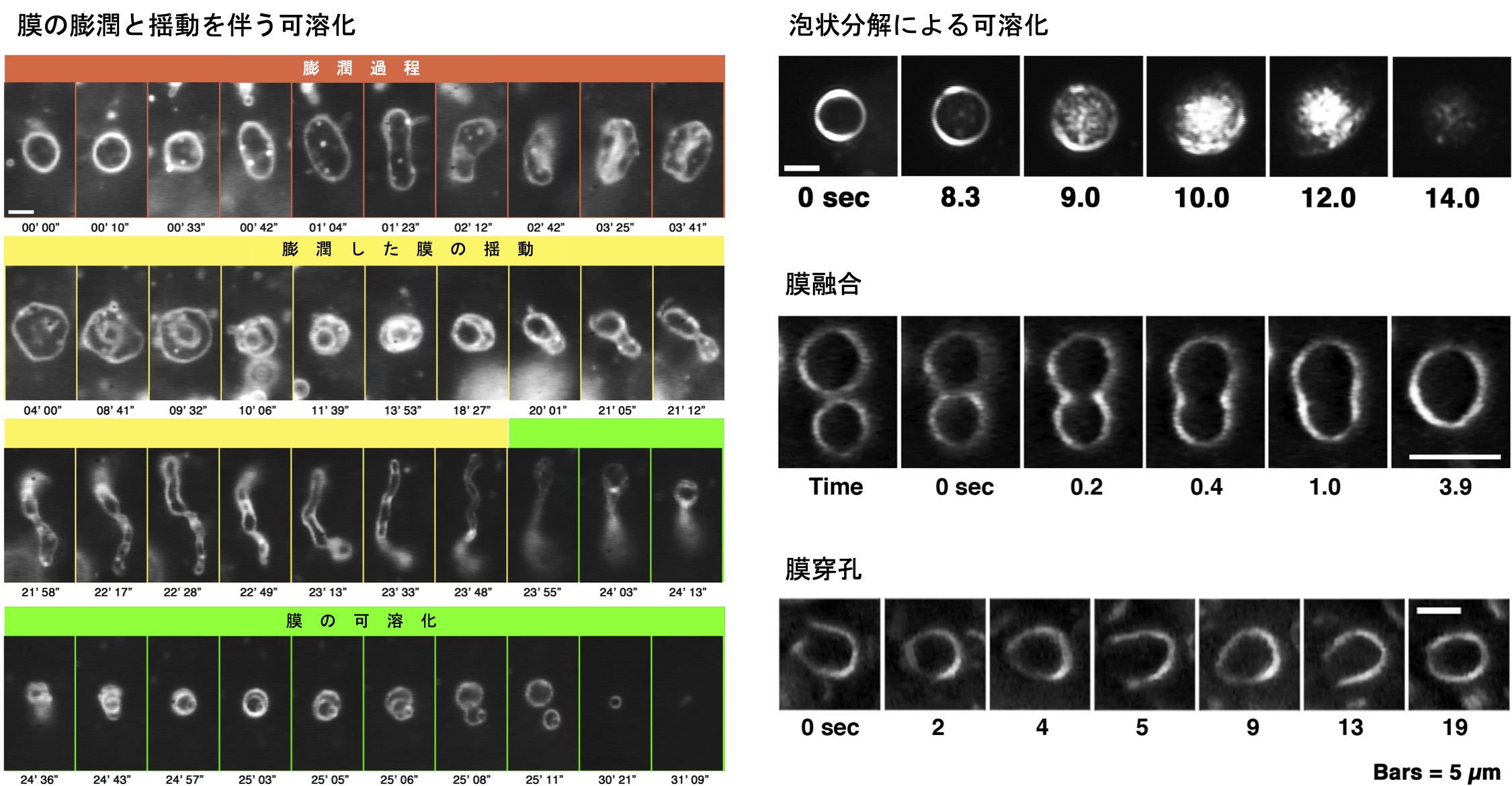
図1 左:蜂毒の主成分であるメリチンを加えた時に起きるリポソームの膜の膨潤及び激しい揺らぎに続いての消失。添加されたメリチンが、リポソーム膜内に侵入して膜面積を拡げ、脂質二重膜構造を撹乱し、最終的に可溶化させてしまう過程だと考えられます。各写真の下の数字は、観察開始からの経過時間、分と秒を示します。右:その他の変化。膜のリン脂質組成や溶液の条件(塩の有無やpH)によっては、メリチンの添加によって、泡状分解(無数の小さな小胞に分かれていく)による可溶化(上)や、リポソーム同士の膜融合(中)、膜穿孔(下)なども起こります。全て暗視野顕微鏡像。
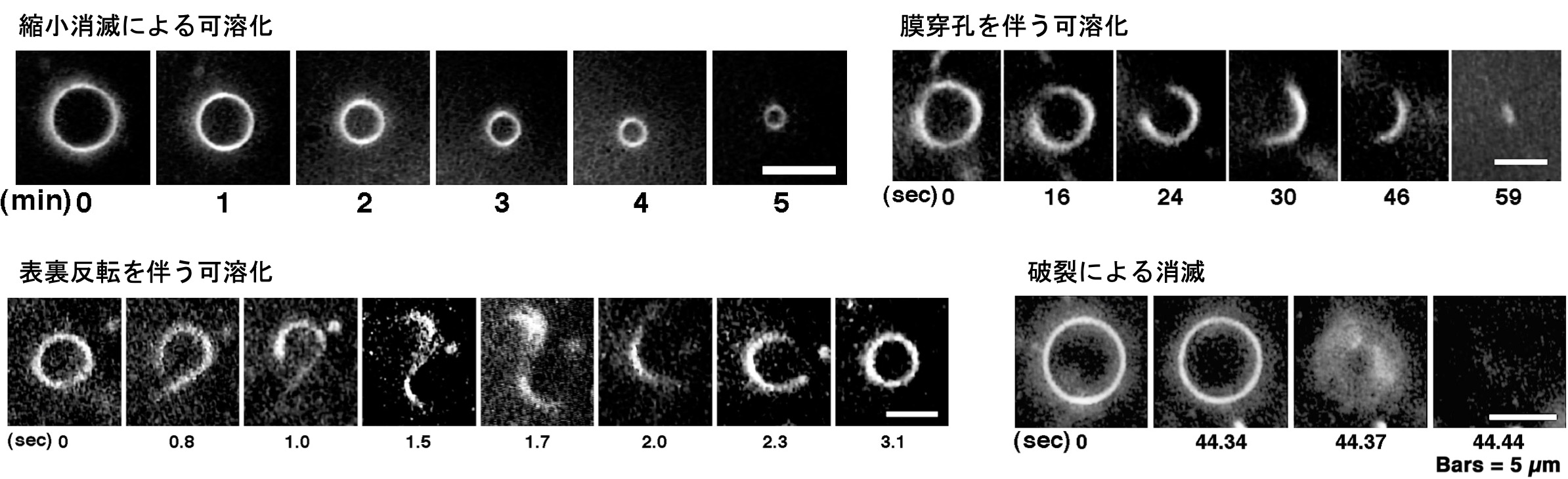
図2 様々なリポソームの可溶化過程。リポソーム膜を構成する脂質の組成及び添加する界面活性剤の種類を変えると、各々の化学的な性質に依存して、異なる可溶化が起こります。左上:徐々に縮小して行き、最後に消滅する場合。右上:膜穿孔を起こしながら消滅する場合。左下:表裏反転を繰り返しながら小さくなっていく場合。右下:破裂して消滅する場合。各写真の下の数字は観察開始からの経過時間です。全て暗視野顕微鏡像。活性を維持させたまま受容体やチャネル/ポンプの様な膜蛋白質を単離する場合に頻繁に用いられる界面活性剤では、左上の様な緩やかな可溶化が多く見られる一方、洗滌力や抗菌活性の強い界面活性剤では、その他の激しい可溶化が観察されます。
■研究概要
蜂毒の主成分のメリチンの様な溶血性のある毒素、あるいは、様々な化学特性(異なる分子量や電荷の有無など)を持つ界面活性剤などが、どの様に脂質二重膜に作用することで細胞膜や生体膜を破壊していくのかを調べるために、細菌の膜や私達の細胞膜を模倣する目的で様々な脂質組成から作製した人工脂質膜小胞(リポソーム)に、上記のメリチン(図1、文献3)、または界面活性剤(図2、文献4)を加えて起きる現象を光学顕微鏡によって直接リアルタイムで観察しました。
なお、リポソームについては本ウェブサイトの「A-20:リポソーム」なども併せてご覧下さい。
■科学的・社会的意義
これらの研究成果や実験手法は、病原体の膜を標的とした新たな抗菌治療薬の開発に活かされています。またこれらの研究は、細胞膜・生体膜の構造の基礎となる脂質二重膜と蛋白質やペプチドやその他の生体由来の化合物との相互作用する仕組みの解明に貢献し、膜に関係して起きる生命現象の分子レベルでの理解に繋がることが期待されます。
■参考文献
1)Kayal, S. & A. Charbit, (2006). “Listeriolysin O: a Key Protein of Listeria monocytogenes with Multiple Functions.” FEMS Microbiology Reviews 30(4): 514–529.
2)Cash, H. L., C. V. Whitham, et al. (2006). “Symbiotic Bacteria Direct Expression of an Intestinal Bactericidal Lectin.” Science 313(5790): 1126-1130.
3)Takahashi, T., F. Nomura, et al. (2013). “Multiple Membrane Interactions and Versatile Vesicle Deformations Elicited by Melittin.” Toxins 5(4): 637-664.
4)Nomura, F., M. Nagata, et al. (2001). “Capabilities of Liposomes for Topological Transformation.” PNAS 98(5): 2340-2345.
■良く使用する材料・機器
1) 位相差蛍光顕微鏡システム BX53 及び BH2 (株式会社オリンパス)
2) 実験試薬 (和光純薬株式会社)
名古屋大学・理学研究科
瀧口 金吾 (たきぐち きんご)
https://www.bio.nagoya-u.ac.jp/laboratory/
「脂質二重膜の柔らかさ丈夫さを知る」
■背景
細胞膜は、主にリン脂質が水溶液中で自己組織化して形成する脂質二重膜に受容体などの膜蛋白質が加わって出来た物です。細胞内外の物質や情報を取捨選択・遣り取りする場として大変重要で、古くから生物学の広い分野で、膜蛋白質や生理活性を持つリン脂質が働く仕組みについて多くの研究が行われて来ています。さて、膜自体の重要さはどうなのでしょうか。勿論、細胞膜が無ければ細胞は生きてはいけませんし、生体膜が無ければ膜に覆われた細胞内小器官、例えばミトコンドリアやリソソーム、はその役割を果たせ無くなります。従って、細胞膜や生体膜、あるいはその基本構造である脂質二重膜に外部から力や刺激を加えた時の柔軟さ、丈夫さを知っておくことはとても大事です。
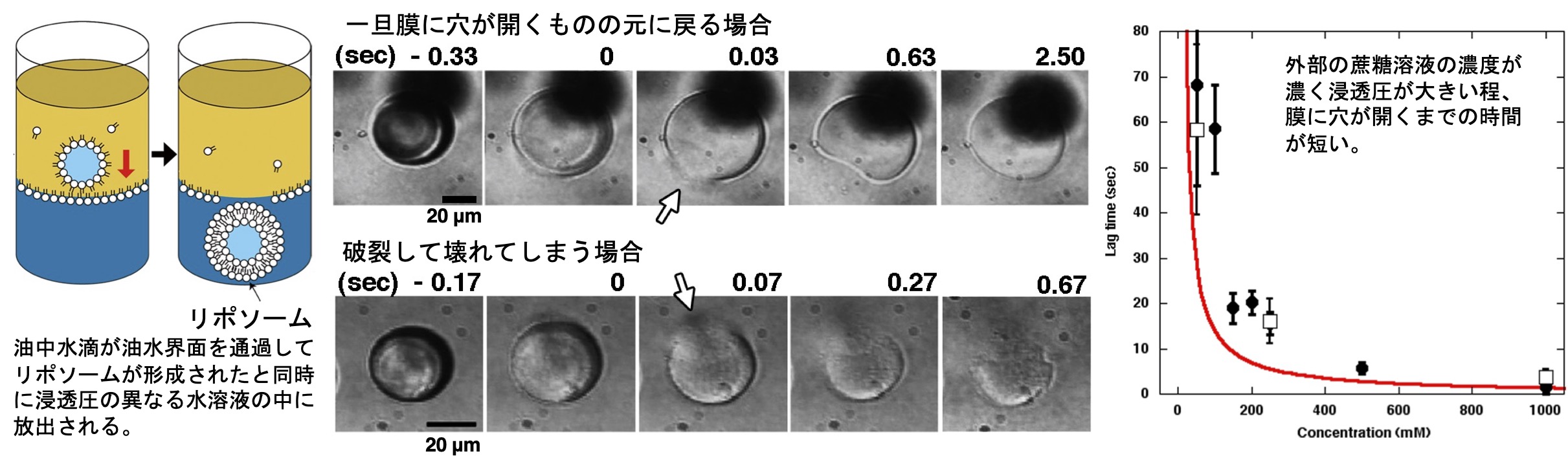
図1 左:浸透圧の異なる溶液(実験で用いたのは、濃度の異なる蔗糖溶液)の中にリポソームを作製する手法を示した模式図。中央:リポソームが示す変化の例。リポソームが形成された瞬間を0秒とした時間経過を示した明視野顕微鏡像。矢印は膜に開いた穴(膜穿孔)を示す。右:外液の蔗糖濃度、つまり浸透圧の大きさ(横軸)とリポソームに膜穿孔の様な変化が起きるまでの時間(縦軸)との関係を示したグラフ。
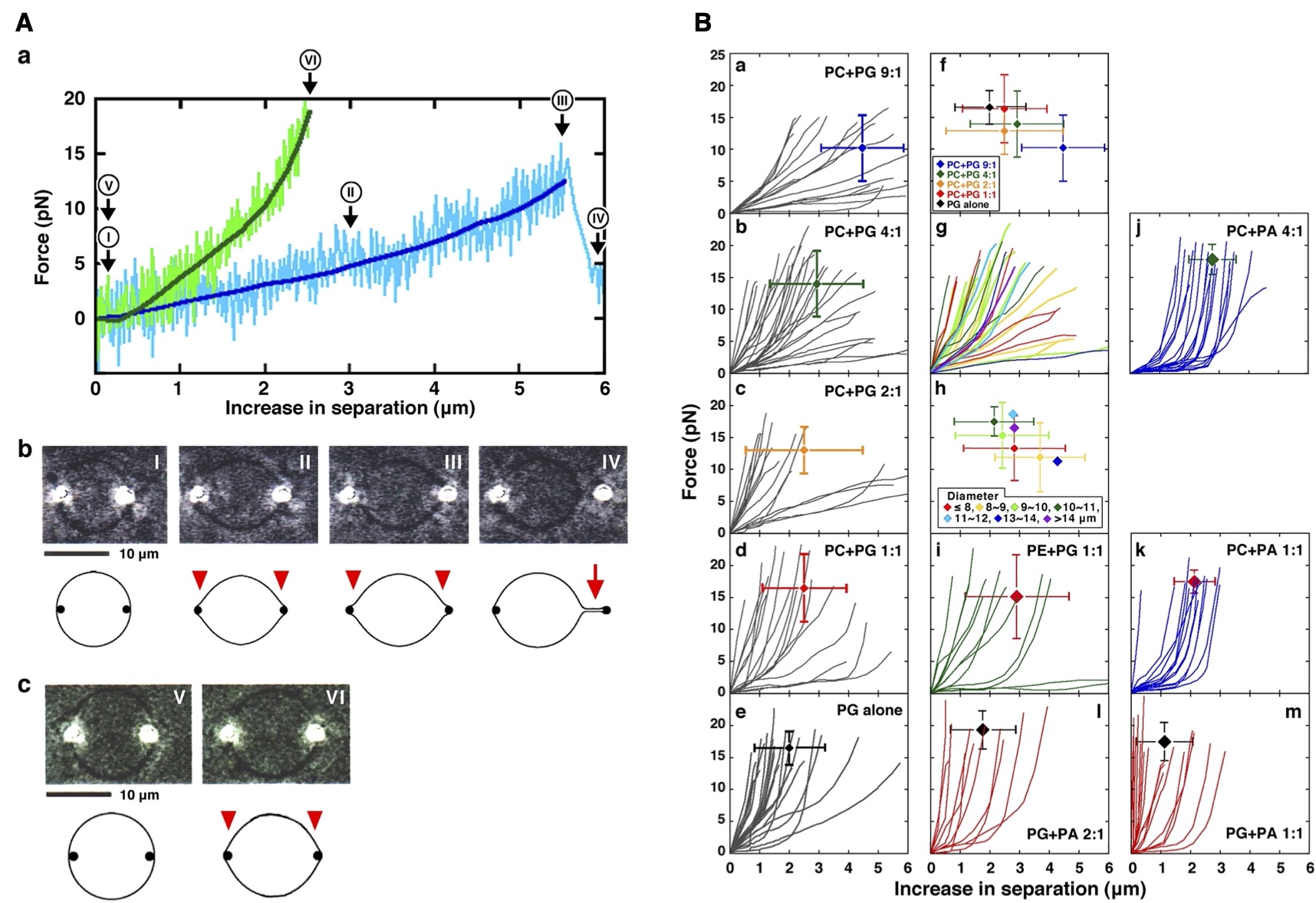
図2 A:中に封入したビーズ(2個)を光ピンセットで操作することによりリポソームを変形させると同時に、その変形に要している力の大きさを測定する手法の概要図。顕微鏡写真中の明るい点、模式図中の黒い点がビーズを表す。ビーズ間の距離を長くしてリポソームを変形させながらその時にビーズにかかっている力を測定する(a)。グラフの横軸は2個のビーズの間の距離、即ちリポソームの変形の程度を示し、縦軸はその時の力の大きさを示す。B:膜のリン脂質組成が異なるリポソームについて測定した変形に要する力(a-e, i-m)。酸性リン脂質(PGやPA)の含有率が高くなる程、変形に必要な力が大きくなる傾向が見られた(f, j-m)。一方、リン脂質をPCからPEに変えても、結果に余り差は見られなかった(i)。なお、リポソームのサイズは結果に影響しなかった(g, h)。
■研究概要
脂質二重膜の柔軟さや丈夫さを調べるために、人工脂質膜小胞(リポソーム)を内部の水溶液(純水または低濃度の蔗糖濃度を使用)と異なる蔗糖濃度の外液に放出することで様々な大きさの浸透圧を加え、その時のリポソームの応答を観察する方法(図1、文献1)、あるいはリポソーム内に2個のビーズを封入しておいて、そのビーズを光ピンセットで操作することで内側から膜を押して変形させた時にどのくらいの大きさの力が必要かを測定する方法(図2、文献2)、を用いました。
その結果、脂質二重膜だけの場合、即ち、結合して補強してくれる様な蛋白質や裏打ち構造を作ってくれるアクチン線維の様な細胞骨格が無い場合、大きな浸透圧を加えると膜に穴が開いてしまうことが分かりました。また、力を加えることでリポソームを変形させる際、膜のリン脂質組成が影響することも分かりました。
なお、リポソームについては本ウェブサイトの「A-20:リポソーム」、生体膜の裏打ち構造の詳細については「B-07:生体膜の静的・動的構造」も併せてご覧下さい。
■科学的・社会的意義
全ての生物、全ての細胞は、細胞膜・生体膜に覆われて外界から区画されることで、その恒常性を保ち機能を維持しています。本研究は、細胞膜・生体膜の構造の基礎となる脂質二重膜の基本的な性質を理解するのに貢献し、膜を標的にした医薬品類の開発や細胞を模倣したマイクロ・ロボットの開発などに応用されることが期待されます。
■参考文献
1)Ohno, M., T. Hamada, et al. (2009). “Dynamic Behavior of Giant Liposomes at Desired Osmotic Pressures.” Langmuir 25(19): 11680-11685.
2)Kato, N., A. Ishijima, et al. (2015). “Effects of Lipid Composition and Solution Conditions on the Mechanical Properties of Membrane Vesicles.” Membranes 5(1): 22-47.
■良く使用する材料・機器
1) 位相差蛍光顕微鏡システム BX53 及び BX60 (株式会社オリンパス)
2) 実験試薬 (和光純薬株式会社)
2022年度分野別専門委員
名古屋大学・理学研究科
瀧口 金吾 (たきぐち きんご)
https://www.bio.nagoya-u.ac.jp/laboratory/
「膜を自在に操り、人工細胞を設計する」
■背景 細胞は、脂質分子が集合して出来たナノメートルの薄い膜(脂質膜)により覆われています。細胞は膜を変形させることで外部の物質を包み込んで吸収し、内部でつくられたタンパク質などを外に排出します。このような膜の動きを支配する物理法則とはどのようなものでしょうか?
■研究概要 この疑問に答えるため、生体細胞膜と同じ構造を持つ人工膜小胞(リポソーム)を用いて、細胞の膜の動きを再現する実験を行っています。光により形状が変化する人工分子をリポソームに加え、膜の孔の開閉を光刺激により制御しました(文献1)。これは、細胞内での物質輸送プロセス「オートファジー」機能を人工的に再現したものです。また、ナノ粒子がリポソームの表面に吸着する様子を観察すると、粒子の大きさによって膜に吸着する領域が異なることを発見しています(文献2)。これは、ナノ物質が細胞内に吸収される初期プロセスを再現したものです。測定データを解析し膜が変形するときのエネルギーを計算することで、これらの実験結果を数式で説明することができます。
■科学的・社会的意義 本研究は、膜の動きを支配する物理法則の解明に役立つと共に、体内で細胞の代わりに働く人工細胞の設計に繋がります。また、様々な物質の細胞膜表面への作用メカニズムを説き明かすことも可能となり、医薬品の作用やナノ物質の安全性を評価する研究への応用が期待されます。
■参考文献
1)T. Hamada, et al. (2010). “Membrane disc and sphere: controllable mesoscopic structures for the capture and release of a targeted object.” J. Am. Chem. Soc. 132: 10528-10532.
2)T. Hamada, et al. (2012). “Size-dependent partitioning of nano/micro-particles mediated by membrane lateral heterogeneity.” J. Am. Chem. Soc. 134: 13990-13996.
■良く使用する材料・機器 1) 位相差・蛍光顕微鏡システム(オリンパス株式会社、株式会社ニコンインステック)
 H27年度分野別専門委員
H27年度分野別専門委員
北陸先端科学技術大学院大学・マテリアルサイエンス研究科
濵田勉 (はまだつとむ)
https://www.jaist.ac.jp/ms/labs/hamada
