揺らぎ・圧力・熱力学
「蛋白質の変性を熱力学的にみると」
■背景
高校の化学では化学平衡を学びます。例えばA⇄Bという反応があったとすると、AからBへの反応速度とBからAへの反応速度が同じになり、見かけ上反応が停止した状態を平衡状態と呼びます。また、そのときの(生成物Bの濃度)/(反応物Aの濃度)は一定値となり、これを(濃度)平衡定数(K)といいます。Aの初めの濃度と平衡定数が与えられれば、Bの平衡状態での濃度は計算できます。化学反応がどれくらい進むのかわかる便利な式です。さらに、熱力学によると、
ΔrGº = –RTlnK
(Rは気体定数, Tは温度, lnは自然対数)という式が導かれ、平衡定数とその反応のエネルギー(標準反応ギブズエネルギー, ΔrGº)が結び付けられます(文献1)。この式はエネルギーという目に見えないものを、AとBの濃度または数の測定から決められることを示しています*。ΔrGºはAとBのそれぞれの安定性の違い、標準化学ポテンシャルの違い(µoB – µoA =ΔrGº)を表しています。化学ポテンシャルは部分モル量の一種で、周り(例えば溶媒)との相互作用の影響も含まれます。
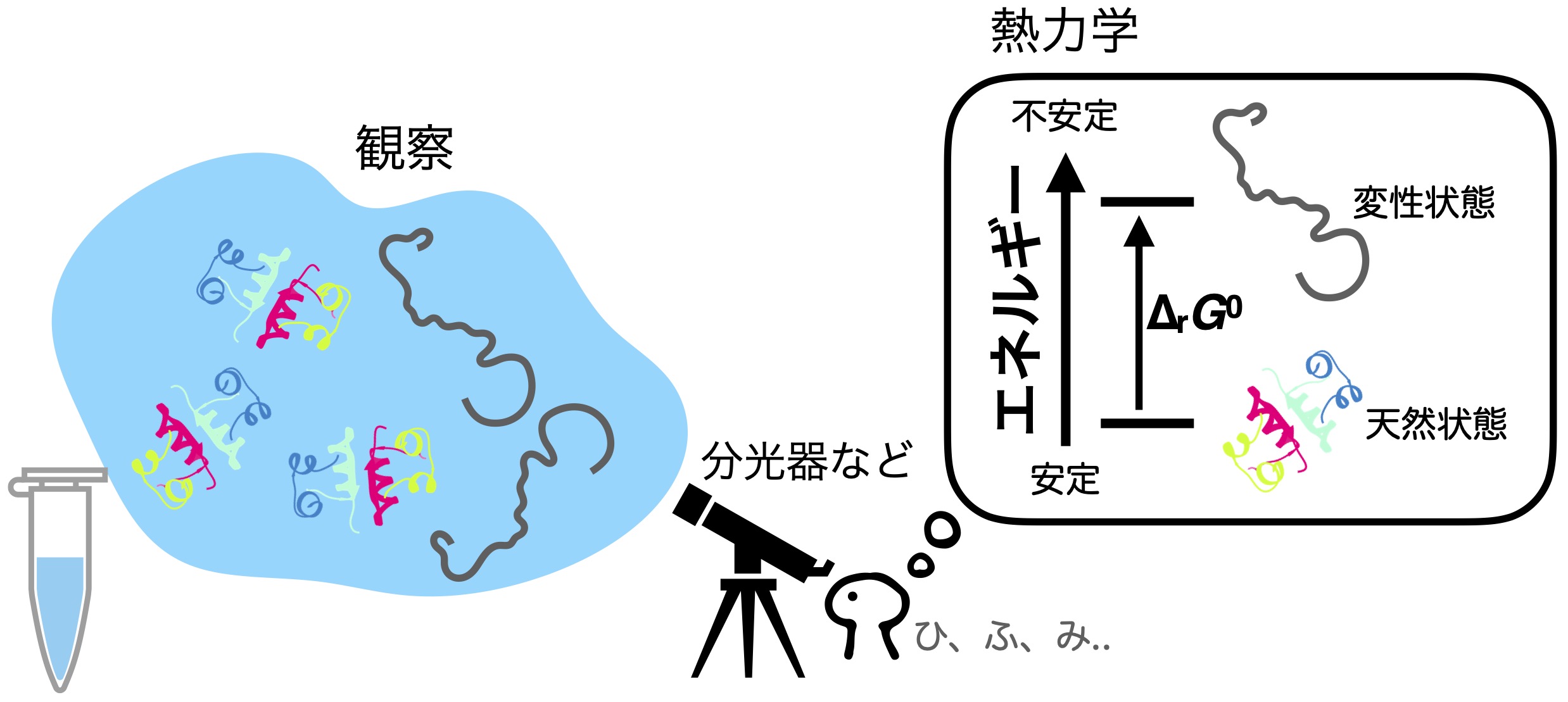
図1. 蛋白質の変性反応の観察と熱力学のイメージ
■研究概要
蛋白質は規則正しい立体構造を保った天然状態(N状態)と構造が崩れた変性状態(D状態)を持つことが知られています。この二つの状態は互いに行き来することができるため、上の例のA⇄Bという反応と同じように、N⇄Dという反応で表すことができます。平衡状態では天然状態の蛋白質分子と変性状態の蛋白質分子は共存し、ある濃度比で一定となります。つまり、蛋白質の変性反応もΔrGº = –RTlnKで解析することができます(図1)。ΔrGºは蛋白質の天然状態と変性状態の安定性の違いを表します。すなわちどれくらい構造が崩れにくいかをΔrGºで評価したり比べたりすることができます。
問題はここからです。蛋白質を積み木のように見れば、あるパーツ(例えば構成するアミノ酸)がどれくらいΔrGºに寄与するかが分かれば、蛋白質を強くしたり弱くしたり自在に操ることができるでしょう。しかし、蛋白質はパーツとパーツの関係が複雑で、これはまだ解明・達成されていません(文献2)。さらに話を難しくしているのは、蛋白質と水の関係です。蛋白質の天然構造が崩れた時(変性)、蛋白質分子の周りの水と触れ合う(水和する)領域が大きくなります。この効果もΔrGºに含まれます。
タンパク質の非極性(炭化水素)部分は疎水基と呼ばれ、これまで変性による非極性部分の水和はΔrGº的にプラスであると考えるのが定説でした。そのため、非極性部分が水を避けるように(“水からしぼり出されるように”(文献3))集合する効果で天然構造が安定化されていると説明されてきました(図2の左のイメージ)。しかし、高精度の理論計算ではΔrGº的にマイナスであることが見えてきました(文献4, 図2の右のイメージ)。つまり、非極性(炭化水素)部分が水を“嫌っている”から天然構造になるという従来のイメージを変える必要がでてきました。
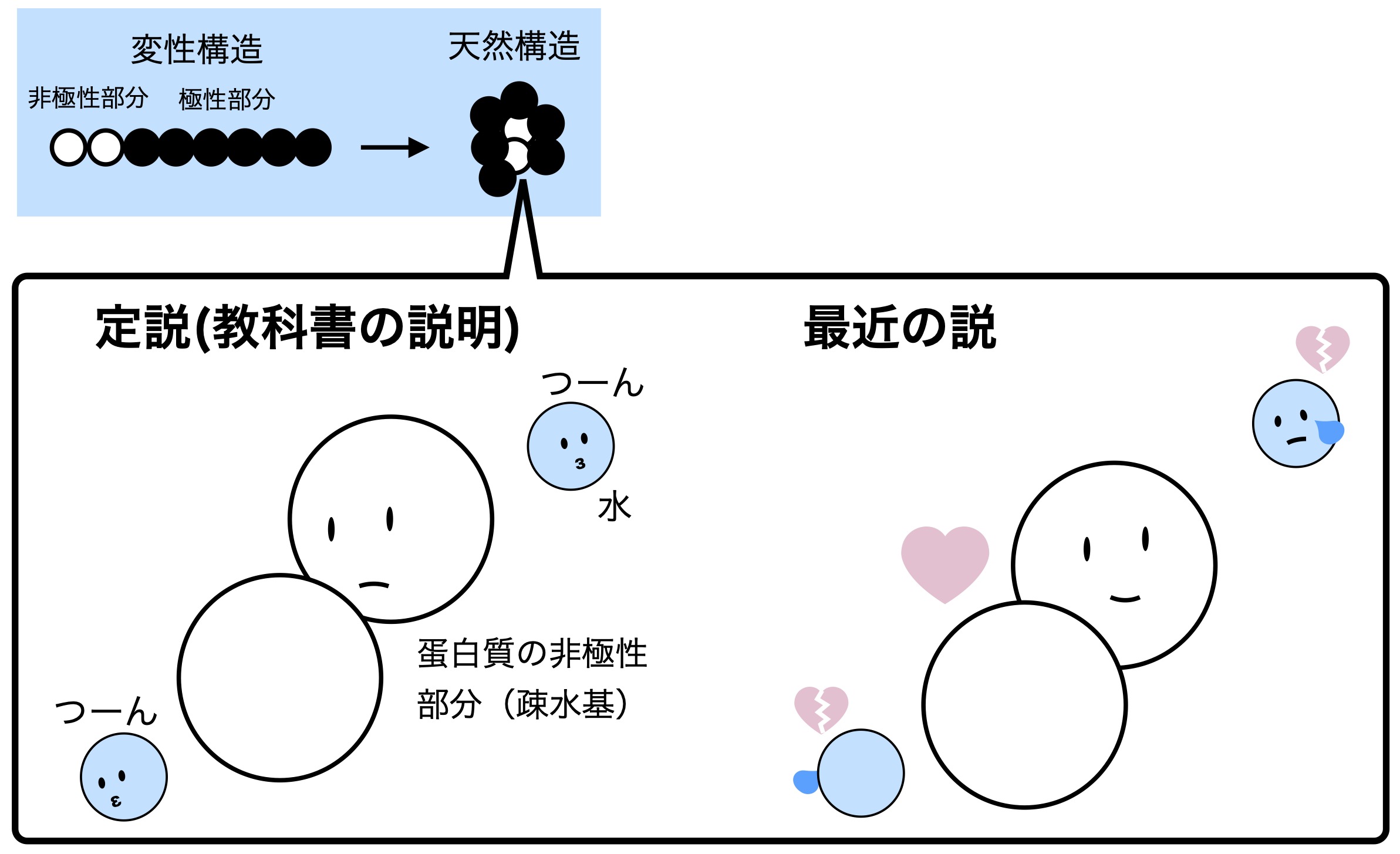
図1. 蛋白質の構造の安定性への水の影響のイメージ
■科学的・社会的意義
蛋白質の安定性の指標であるΔrGºとその要因の解明が進めば、蛋白質を改変したときの利益やリスクを予測することができるようになります。これは抗体など蛋白質を主成分とするバイオ医薬品の新薬開発でも望まれています(文献5)。
また、熱力学の関係式を使うとΔrGºよりさらに深い解析や洞察が得られます。例えば、
(∂ΔrG∘/∂p)=∆rV∘
という式があります。これは圧力(p)をかけたときの応答を観測することで、変性による蛋白質の体積変化(ΔrVº = 変性構造の体積 – 天然構造の体積. ただし部分モル体積)がわかることを意味しています。通常は変性構造の体積が小さいので、ルシャトリエの原理より、圧力をかけると変性します(文献6)。天然構造の中の空洞や変性に伴う水和による体積の収縮・膨張などが見えてきます。またΔrGºの温度依存性からエンタルピーや熱容量の情報が得られます。熱容量は蛋白質の変性でどれくらい構造の揺らぎが増えたか(文献7)、どれくらい非極性表面が増えたか、といったことと関連付けて理解されます。
AI技術で蛋白質設計が可能になってきた現代、それが適切なものか評価し、理解するときに熱力学解析が重要な役割を果たします。つまり、構造的な蛋白質らしさだけでなく、熱力学的な蛋白質らしさも求めていく必要があります。
蛋白質は時間とともに変異をして進化する分子です。クジラやアザラシの筋肉中のミオグロビンという蛋白質は、進化とともにΔrGºが大きくなり、構造が安定化してきたことがわかってきました(文献8, 9)。クジラやアザラシが陸棲から水棲へ進化してきたことはよく知られています。生物が海に潜る能力と蛋白質の安定性の向上にどのような関係があるのか?そのメカニズムなどもこれからの興味深い課題です。
■参考文献
1)小口達夫, 梶本興亜, 山崎勝義, (2023) “化学ポテンシャルと平衡定数”, 漁火書店. https://ir.lib.hiroshima-u.ac.jp/00014986: 本文献内の記号の定義に従えば、ΔrGºc(T) = –RTlnKc(T)と表される。
2)Chen et al., (2023) “Protein folds vs. protein folding: Differing questions, different challenges.” Proc Natl Acad Sci U S A. 120: e2214423119. https://doi.org/10.1073/pnas.2214423119
3)D. Voet, J. Voet (田宮ら訳) (2012) “ヴォート生化学 第4版”, 東京化学同人.
4)Sumi, S., Imamura, H., (2021) “Water-Mediated Interactions Destabilize Proteins.” Protein Sci. 30: 2132-2143. https://doi.org/10.1002/pro.4168; 立命館大学プレスリリース. https://www.ritsumei.ac.jp/file.jsp?id=507854
5)津本浩平, 石井明子, 内山進, 本田真也, (2022) "品質評価のカギをにぎる バイオ医薬品の分析法 知っておきたい基礎×一歩進んだ応用", じほう.
6)加藤稔, 今村比呂志, (2014) “タンパク質の圧力変性機構:現状とこれからの課題” (CSJカレントレビュー17 極限環境の生体分子, p103-109), 化学同人.
7)Cooper, A., (2010) “Protein Heat Capacity: An Anomaly that Maybe Never Was.” J. Phys. Chem. Lett. 1: 3298-3304. https://doi.org/10.1021/jz1012142
8)Isogai, Y., Imamura, H., Nakae, S., Sumi, T., Takahashi, K., Nakagawa, T., Tsuneshige, A., Shirai, T. (2018) “Tracing whale myoglobin evolution by resurrecting ancient proteins.” Scientific Reports 8: 16883. https://doi.org/10.1038/s41598-018-34984-6
9)Isogai, Y., Imamura, H., Nakae, S., Sumi, T., Takahashi, K., Shirai, T. (2021) “Common and unique strategies of myoglobin evolution for deep sea adaptation of diving mammals”, iScience 24, 102920. https://doi.org/10.1016/j.isci.2021.102920
*本稿では非理想性は無視して記述しています。
■良く使用する材料・機器
1) 赤外、紫外可視、蛍光、円偏光二色性分光装置 (日本分光株式会社)
2) 実験試薬 (和光純薬株式会社、ナカライテスク株式会社、渡辺化学工業株式会社)
3) 小角X線散乱装置 (放射光施設Photon Factory)
4) ゲルろ過カラム、逆相カラム (東ソー株式会社)
5) 液体クロマトグラフィー装置 (島津製作所)
6) pH分析機器 (堀場製作所)
 2024年分野別専門委員
2024年分野別専門委員
長浜バイオ大学・バイオサイエンス学部
今村比呂志 (いまむらひろし)
https://researchmap.jp/7000020443?lang=ja
「圧力実験からわかるタンパク質の構造変化」
■背景 温度に比べ、圧力を変化させることができる実験技術の発展が遅れているため、圧力に対する分子や細胞、生物の応答については未解明な部分が多いです。深海の世界は高圧力ですが、深海生物のタンパク質や分子間の相互作用はどのような影響を受けるのでしょうか?圧力実験をすることで何がわかるのでしょうか?その幾つかを紹介します。
■研究概要
数百〜数万気圧の静水圧を用います。水深10メートルで約1気圧増加しますので、世界で最も深いマリアナ海溝(約-11,000 m)などの深海やそれ以上の環境も実験室で作り出せるのです。圧力は、深海生物の研究のみならず、分子の物理平衡、化学平衡を調べる道具(環境因子)としても有用です。例えば、水の相図がありますが、1気圧ではお馴染みの氷Iなどわずかな相の観測しかできませんが、1000気圧〜10,000気圧では、氷II、III、V、VI ...と10程度の相が存在します。タンパク質でいうと、常温・常圧で最も安定に存在する構造はよく知られていますが、「わずかに存在する構造」はほとんど研究されていません。この「わずかに存在する構造」への転移を、「構造揺らぎ」と言ったりします。熱力学的には、そのような構造は生理条件下でも存在するといえ(化学平衡)、タンパク質の働きや、プリオン病などタンパク質の異常凝集疾患に関わっている可能性が指摘されています1,2。圧力により物理平衡、化学平衡を変化させることで、「わずかに存在する構造」の濃度を増加させることができます。例えば、圧力を使った核磁気共鳴(NMR)実験によりタンパク質の「わずかに存在する構造」の原子座標決定に成功しました(図1)。
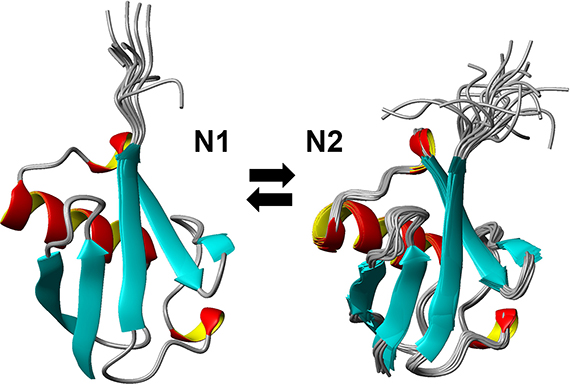
図1 ユビキチンの最安定状態(N1)と準安定状態(N2)の20構造モデル。N1構造は、野生型ユビキチンについて、1気圧、298 Kにて解明された(PDB:1D3Z)。N2構造は、ユビキチンQ41N変異体について、2500気圧、298 Kにて解明された (PDB:2RU6)。N2構造は、生理条件下では10%程度しか存在しない「わずかに存在する構造」であり、10マイクロ秒程度の時間スケールでN1とN2の2構造間を行き来しています。N2構造は、C末端領域の配向がN1構造に比べ外側に反っています。変化している領域は標的タンパク質との相互作用部位も含んでおり、機能への影響が予想されます。
■科学的・社会的意義 多くの薬はタンパク質に作用します。標的となるタンパク質のかたちがわかれば、病気につながる分子間相互作用を阻害したりする医薬品の設計ができます。これを構造に基づく医薬品設計(Structure-Based- Drug -Design)といいます。タンパク質の「わずかに存在する構造」にまでこの手法を拡張することにより、より合理的な医薬品開発につながる可能性が有ります。
■参考文献
1)Kitazawa , S. et al. (2014). "Close Identity between Alternatively Folded State N2 of Ubiquitin and the Conformation of the Protein Bound to the Ubiquitin-Activating Enzyme." Biochemistry 53: 447-449.
2)Kuwata et al. (2007). "Hot Spots in Prion Protein for Pathogenic conversion. PNAS USA 104: 11921-11926.
■良く使用する材料・機器
1) 核磁気共鳴装置(NMR) (ブルカー・バイオスピン株式会社)
2) 実験試薬 (和光純薬工業株式会社、ナカライテスク株式会社)
3) 無細胞系でのタンパク質発現・無細胞くん(大陽日酸株式会社)
 H27年度分野別専門委員
H27年度分野別専門委員
立命館大学・薬学部
北原亮 (きたはらりょう)
https://www.ritsumei.ac.jp/pharmacy/kitahara/kitahara_lab.html
「分子の運動や反応を支配する一般法則」
■背景 タンパク質やDNAやRNAといった核酸、糖、脂質二重膜などは生体を構成する代表的な分子ですが、これらのほとんどは非常に複雑な構造を持ち、さらに複数の分子同士がお互いに集まることで非常に巨大な系を作り出します。 そしてこれらの分子は私たちの体の中である決まった構造を取るのではなく、常に揺らぎながら存在していることが知られています。その揺らぎのもととなるのが分子の熱運動であり、 生物の体の中にある分子は盛んに熱運動を行いながら、様々な化学反応や機能を発揮しています。もしこの熱運動が無いとすれば、生体分子は生きていくために必要な、いかなる反応も行うことができません。 従って熱運動とそれがもたらす揺らぎは生物にとって最も基本となるエネルギー源であるといえます。そして熱運動を行う分子は様々な化学反応を行いますが、この時反応は全く無秩序に起こる訳ではありません。 「熱力学」という物理法則に従って反応が進んでいきます。そしてその方向性を決めるのがギブスの自由エネルギー(G)と呼ばれる物理量で、全ての化学反応はこのGが低くなる様に、即ち自由エネルギー変化(ΔG) が負になる方向へ進むことが決まっています(図1)。このΔGはさらに生体内では発熱量に相当するエンタルピー(ΔH)変化と系の乱雑さの変化を示すエントロピー変化(ΔS)および温度Tを用いてΔG = ΔH - TΔSのように表すことができます。ここでΔHやΔSは反応を決める非常に重要な物理量ですが、それぞれ温度や圧力に依存するため、それらを変えると反応の方向性や効率が変化します。 この温度や圧力の依存性は分子の構造や反応過程の機構を反映しているため、それらを変えた実験を行うことで生体分子の構造や揺らぎについてより詳細な知見を得ることができます。 また化学反応は必ずΔGが負になる方向へと進行しますが、この時多くの反応では不安定な活性中間体を経る必要があります。この活性中間体の反応物に対するギブス自由エネルギーの差は活性化エネルギー (ΔG‡)と呼ばれ、D‡が大きいほど反応速度が高く、短い反応時間で反応が進行するのに対し、逆にΔG‡が小さいとより長い時間を反応に要することになります。そして生体分子はこのΔG‡を 調節することでより生存に適した速度で化学反応を進めていると考えられています。
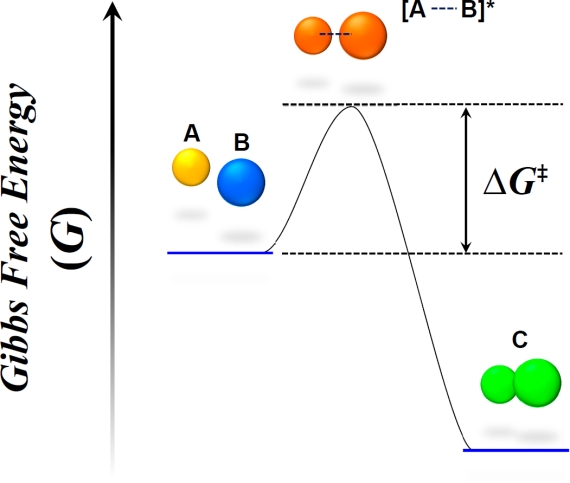
図1 化学反応の方向姓はギブスの自由エネルギー(G)によって決まり、よりGが小さくなる方向へと進行する。またその反応速度は活性化自由エネルギー(ΔG‡)によって決まり、ΔG‡が小さいほど反応がより速く進行する。
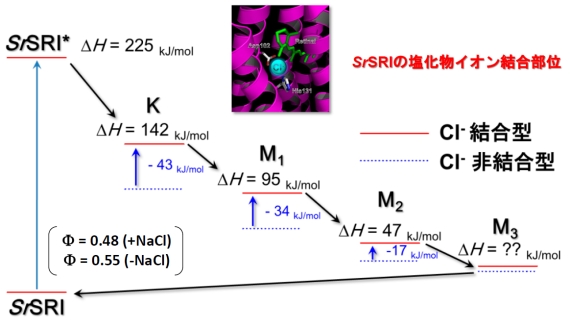
図2 過渡回折格子(TG)法によって明らかになった、SrSRIの各光反応中間体のエンタルピーダイアグラム。タンパク質に塩化物イオンが結合すると、各中間体のエンタルピーが大きく上昇する。
■研究概要
これまでGやH、Sといった熱力学量は、温度や圧力を変えた時に、平衡状態にある分子の割合がどう変化するのかを調べることで、平衡下にあるそれぞれの化学種の相対的な値を求めることで研究が行われてきました。しかし生体反応の多くは平衡反応だけではなく、一方向だけに反応が進行する逐次反応であり、一般にその途中には多くの反応中間体が現れますが、それらの反応中間体について上記のような熱力学量を決めるのは困難でした。しかし私たちは最近パルスレーザーを使った過渡回折格子法(TG法)と呼ばれる分光法で中間体のエンタルピーを決定することに成功しました。TG法ではごく短い時間(ナノ秒(十億分の一秒)程度)だけ試料に光を照射して、その中に含まれる分子を一度に光反応させ、その後に起こる反応過程に沿って生じる屈折率変化を測定できる手法です。この時光を吸収した分子が中間体へと変化していくと徐々にエネルギーが熱として放出されていきますが、熱が放出されると試料の屈折率が変化するため、それを正確に測定することで様々な中間体の持つエンタルピーを決定することができます。
私たちはこのTG法を使ってSalinibacter ruberという細菌が持つ光受容タンパク質である、センサリーロドプシンI(SrSRI)の光反応過程を調べました。その結果図2に示すようにSrSRIの光反応の経路上に存在する大部分の中間体について、その始状態からの相対エントロピー(ΔH)を決めることに成功しました。さらにSrSRIは塩化物イオンを結合する事が知られていますが、全ての中間体においてこのΔHが塩化物イオンの結合と共に上昇することが明らかとなりました。このことは塩化物イオンが結合する事でタンパク質の反応速度や構造に違いが生じ、それが機能と深く結びついていることを示唆しています。このような結果はレーザー分光と熱力学研究を組み合わせることで、初めて可能になったものであり、現在より詳細な知見を得るために、さらに詳細な研究を行っています。
■科学的・社会的意義 生体反応は生き物が生きていくために必要なものの中で、最も基本的な過程です。その原理を熱力学で明らかにすることは生化学的な知見を増やすだけでなく、様々な反応を自由に制御するという目標にもつながるものであり、将来的には製薬や医療といった応用的な分野へも貢献が期待されます。
■参考文献
1)Inoue, K., et al. (2011). "Spectrally Silent Intermediates during the Photochemical Reactions of Salinibacter Sensory Rhodopsin I." J. Phys. Chem. B 112(8): 2542-2547.
■良く使用する材料・機器
1) Nd3+:YAGレーザー(INDY 40)(Spectra Physics)
2) デジタルホスファオシロスコープ(テクトロニクス)
3) 実験試薬 (和光純薬株式会社)
 H24年度分野別専門委員
H24年度分野別専門委員
名古屋工業大学・大学院工学研究科・未来材料創成工学専攻
井上圭一 (いのうえけいいち)
http://www.ach.nitech.ac.jp/~physchem/kandori/index_j.html
