記憶・学習・思考
「神経細胞の中で起こる生化学反応を見て、記憶の原理を分子レベルで理解する」
■背景
多くの方はふとした時に次のような疑問を持ったことがあると思います。
なぜ昔体験した出来事を覚えているのか?
脳は機械と異なって柔らかい組織ですし、それらを構成する細胞内のタンパク質や脂質の多くは拡散しています。また、脳には多くの血管が入り込んでいて血流もあります。なぜ、このような分子が動的にふるまっている場所に記憶を長期間保存できるのでしょうか?
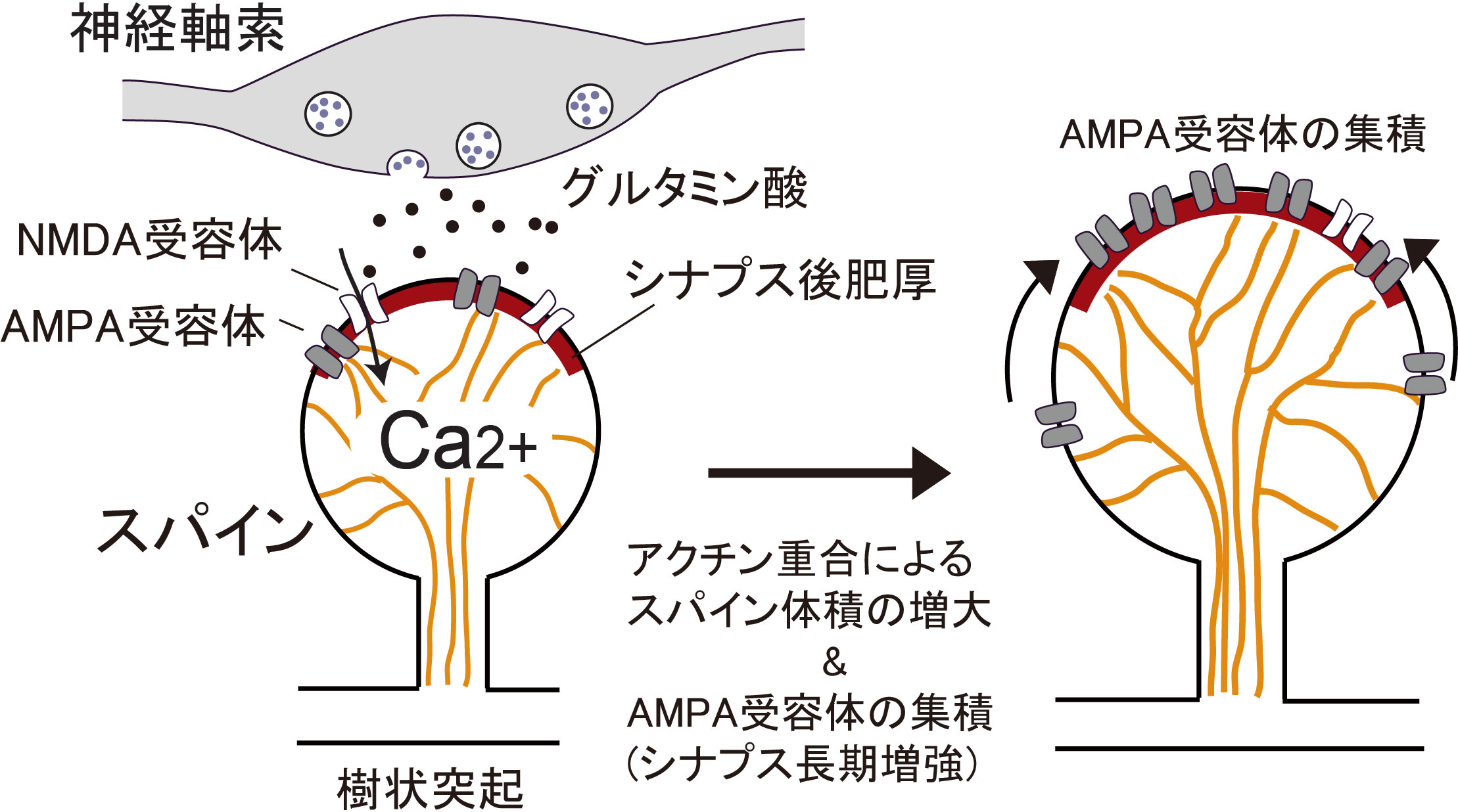
図1 樹状突起スパインとアクチンフィラメントの模式図。
樹状突起スパインの形状(キノコ状構造)は、アクチンフィラメント(オレンジ色)によって維持されています。グルタミン酸がNMDA受容体に結合すると、NMDA受容体を介してスパインへのCa2+流入とシグナル伝達タンパク質の活性化が起こり、アクチン重合によるスパイン体積の増大とAMPA受容体のシナプス後肥厚への集積が起こります。AMPA受容体の集積によってスパインのグルタミン酸に対する感度が上がります(シナプス長期増強)。

図2(左)筆者の研究室の2光子蛍光寿命イメージング顕微鏡。(右)顕微鏡内部の仕組み(単一光子計数法による蛍光寿命測定)(文献1 )。
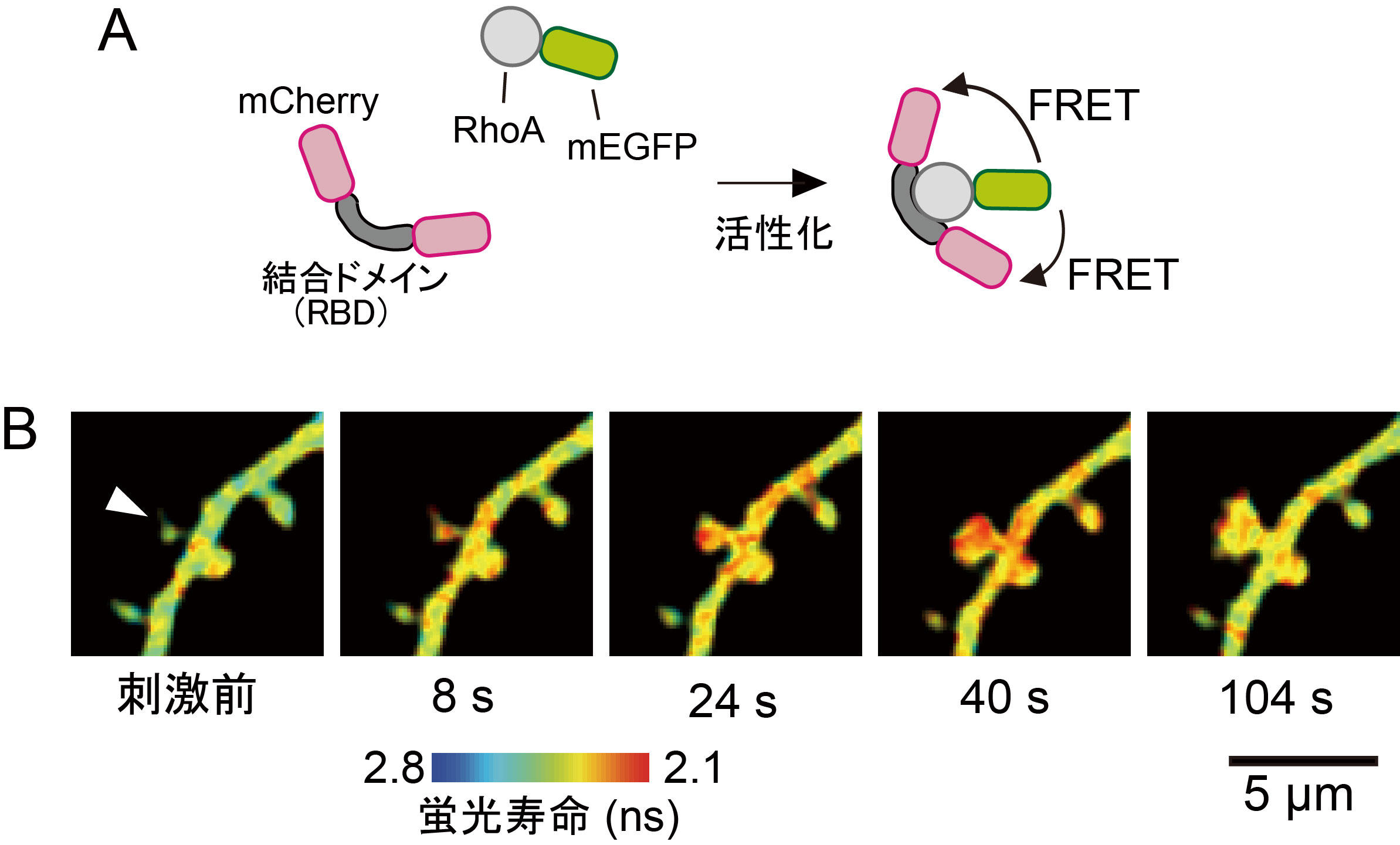
図3(A)RhoA FRETプローブ。(B)FRETプローブを発現した神経細胞の蛍光寿命イメージング像。樹状突起上の矢尻で示したスパインをグルタミン酸によって刺激しました。暖色はRhoAの活性化(蛍光寿命の減少、すなわちFRETの増加)を示している。(文献3,4)
■研究概要
脳組織は主に神経細胞、グリア細胞から構成されています。現在までに多くの神経学者らの努力によって、神経細胞のネットワーク、特に、神経細胞同士を繋いでいるシナプスと呼ばれる領域が記憶にとって重要な役割を果たしていることが分かってきました。このような背景のもと、私達は、世界最先端の手法である2光子蛍光寿命イメージング顕微鏡法(2-photon fluorescence lifetime imaging: 2pFLIM)を用いて、生きた脳組織内の神経細胞シナプス内の様々な反応を可視化することで、シナプスとその可塑性の仕組みを明らかにしてきました。蛍光分子の蛍光寿命を測定することによって、pH、温度、イオン強度、フェルスター共鳴エネルギー移動(FRET)などの蛍光分子周辺環境を定量的にモニターできます。特に近年、蛍光寿命測定によるFRET検出法を2光子励起や蛍光タンパク質と組み合わせることによって、細胞内タンパク質同士の結合・解離や構造変化を、組織深部に位置するシナプスのような微小領域(~1 µm)でも観察できるようになってきました。
樹状突起スパイン
海馬の興奮性神経細胞は樹状突起上に樹状突起スパインと呼ばれる小さな球状の頭部(0.01 – 1 µm3)と細いくびれ(幅50 – 300 nm)を持つ突起を持っています。スパイン頭部にはNMDA受容体、AMPA受容体、PSD95などの受容体や足場タンパク質があり、これらの分子の一部はシナプス後肥厚に局在しています(図1)。スパイン頭部はシナプス前部から放出されたグルタミン酸を受け取り、Ca2+の流入とスパイン内でのシグナル伝達の活性化を引き起こします。例えば、2光子グルタミン酸アンケージングによる単一スパインのグルタミン酸刺激は、スパインへのCa2+流入とスパイン内のシグナル伝達分子の活性化を誘導します。グルタミン酸のアンケージング刺激を繰り返すと、スパインの構造的長期増強(sLTP)と呼ばれる、1時間以上の持続的なスパインの体積増加が誘導されます。
2FLIMによる神経シナプス内分子活性化イメージング
2pFLIM(図2)を用いると組織内で起こる生化学反応を可視化できます。ここでは、海馬スライス神経細胞の単一シナプス内RhoA活性化イメージングについて紹介します。RhoAは低分子量Gタンパク質であり、アクチンの重合・脱重合を制御する分子としてよく知られていますが、活性化の時空間分布は分かっていませんでした。RhoAの活性化を可視化するためのFRETとプローブとして、RhoAをmEGFPに融合したものをFRETドナーとし、mCherryをRhoA結合ドメイン(RBDと呼ばれる81個のアミノ酸から成り、活性化型RhoAに結合)に融合したものをアクセプターとしました(図3)。シナプス内でmEGFP-RhoAが活性化すると、mEGFPとmCherryの距離が近くなりFRETが起こります(mEGFPの蛍光寿命が短くなる)。このFRETセンサーを発現する細胞にケイジドグルタミン酸を720 nmの2光子励起で光解放することにより単一シナプスにグルタミン酸刺激を与えたところ、RhoAはスパイン内から活性化し樹状突起や近隣のスパインに広がることが分かりました。今後、このような計測を様々なシグナル分子に応用することで、神経細胞内シグナル伝達機構の動作原理が明らかになることが期待されます。
■科学的・社会的意義 2光子蛍光寿命イメージング顕微鏡を用いることによって、組織やin vivoでの神経細胞におけるタンパク質活性やタンパク質間相互作用を可視化できます。この技術は、より幅広い応用が可能で、例えば、FLIMはアルツハイマー病などの病理学的メカニズムの解明に応用されています。 タンパク質の状態は多くの脳疾患に深く関与しているため、FLIMは脳疾患のメカニズム解明を可能にする強力な技術となると考えられます。
■参考文献
1) Murakoshi H. Optogenetic imaging of protein activity in the synapse by using 2-photon fluorescence lifetime imaging microscopy. Optogenetics. Springer-Verlag, the Advances in Experimental Medicine and Biology book series, Germany. 295–308 (2021).
2) Ueda HH, Nagasawa Y, and Murakoshi H Imaging intracellular protein interactions/activity in neurons using 2-photon fluorescence lifetime imaging microscopy. Neuroscience Research, 179, 31–38 (2022).
3) Murakoshi H, Wang H, and Yasuda R. Local, persistent activation of Rho GTPases during plasticity of single dendritic spines. Nature 472, 100–104 (2011).
4) 村越秀治 「分子間相互作用を検出する2光子蛍光寿命イメージング」
生体の科学 医学書院 2017年10月 68(5) p400–401
■良く使用する材料・機器 エビデント社(旧オリンパス)蛍光顕微鏡をベースにした自作の2光子蛍光寿命イメージングシステム
 R5年度分野別専門委員
R5年度分野別専門委員
自然科学研究機構・生理学研究所
村越 秀治(むらこし ひでじ)
https://www.nips.ac.jp/multiphoton/02_Research.html
「古典的条件付けを用いて無意識の記憶のしくみを探る」
■背景
記憶は我々の頭の中でどのようにつくられ、保たれるのでしょうか?記憶には、主に顕在記憶と潜在記憶の二種類が存在します(図1)。顕在記憶は、自分が昔どこで何をして、そのときどのように感じたかといった思い出のように、意識が必要な記憶とされています。一方、潜在記憶とは、練習によって自転車に上手に乗れるようになったり、あるいはテニスの技術が上達したりというように、意識せずに身体の制御や技能が熟練するようなタイプの学習です。この潜在学習のおかげで、我々は無意識のうちに倒れずに自転車に乗れるようになるわけです。では、この「無意識の記憶」は脳のどこにどのように貯えられているのでしょうか?
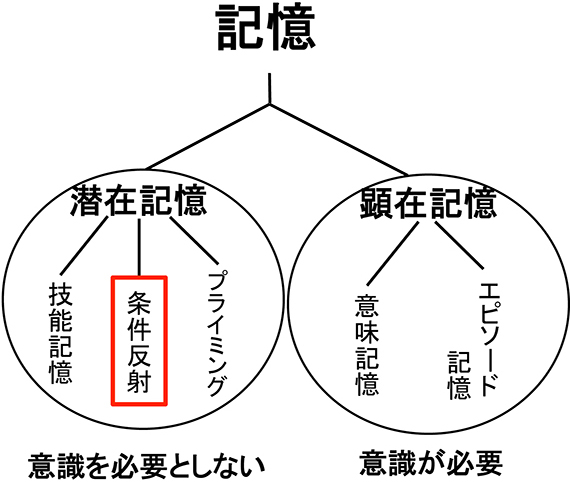
図1 記憶の分類: (長期)記憶には潜在記憶と顕在記憶の2種類が存在します。前者では記憶の獲得や再現に意識を必要とはしないのに対し、後者には意識が必須です。潜在記憶は、さらに技能記憶や条件反射、プライミングなどに分類されます。
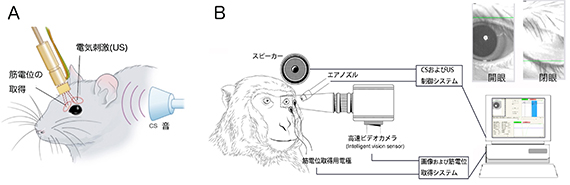
図2 マウスとサルにおける瞬目反射条件づけの模式図
A:マウスに対する条件づけシステム。4本のステンレス電極を配したコネクタがマウス頭部に固定され、筋電位の取得と電気刺激のために用いられる。
B:サルに対する条件づけシステム。モンキーチェアにサルを座らせ、スピーカーからの音とエアノズルからの瞼への空気刺激を繰り返し対提示すると、やがて音だけで瞼を閉じるようになる。条件反射は、高速カメラ法と電極による眼輪筋筋電図法筋電位法によって取得•解析される。本システムでは同時に瞼の開閉状態によって覚醒の度合いも判定することが可能であり、右上に、覚醒度が高い場合(左)と低い場合(右)のサルの眼の状態例を示している。
■研究概要 我々は、潜在学習の脳内メカニズムを明らかにするために、瞬目反射条件づけとよばれる古典的条件づけを道具として生物物理学的研究を行っています。古典的条件づけで最も有名なのは皆さんもご存知の“パブロフの犬”だと思いますが、瞬目反射条件づけでは、音を条件刺激(CS)とし、瞼への軽微な刺激を無条件刺激(US)とした場合、両刺激を同時に繰り返し何度も与えると、音を与えただけで、無意識にまばたきの条件反射(CR)が起こるようになるのです(図2)。我々は、この瞬目反射条件づけを、遺伝子を改変したマウスや、人間により近いほ乳類であるサルに適応して「無意識の記憶」ができる仕組みを調べています(サルに対しては、世界で初めての評価システムを開発しました)。瞼の動きは、高速ビデオカメラ法、あるいは瞼の筋肉の筋電図(EMG)法を組み合わせることによって行います(図2)。これまでに、小脳の神経細胞に発現する多くの機能分子(例えばある種のグルタミン酸受容体や脳内マリファナ受容体)や小脳の神経回路が、この潜在学習に必要であることを明らかにしました。また、人間のアルツハイマー病やプリオン病のモデルマウスでも、この学習に障害が見られることも解き明かしています。さらに、サルの実験では、睡眠中の状態でも潜在学習の記憶を出現させるという興味深い現象を見いだしました。
■科学的・社会的意義 瞬目反射条件づけの小脳における学習機構は、脊椎動物の記憶・学習系の中で、関与する神経回路がもっとも詳しく同定されたものの一つです。また、瞬目反射条件づけは、疾患モデル動物の認知機能の測定法としても期待されており、さまざまな神経疾患の治療法の探索への応用など、今後は前臨床研究や創薬のツールとしても有望だと考えられます。さらには、(無)意識と学習の関係を調べる方法論としても非常に優れた実験系で、今後はこの観点からの応用も期待されます。
■参考文献
1)Kishimoto Y, Yamamoto S, et al. (2015) "Implicit memory in monkeys: development of a delay eyeblink conditioning system with parallel electromyographic and high-speed video measurements." PLoS One 10 (6): e0129828. (サルで初めて瞬目反射条件づけを解析し、覚醒度と学習の関係を論じた論文)
2)Ohtani Y, Miyata M, et al. (2014). " The synaptic targeting of mGluR1 by its carboxyl-terminal domain is crucial for cerebellar function." J Neurosci 34(7): 2702-2712.
3)Kishimoto Y, Hirono M, et al. (2013). "Age-dependent Impairment of eyeblink conditioning in prion protein deficient mice." PLoS One 8 (4): e60627.
4)Miyata M, Kishimoto Y, et al. (2011). "A role for myosin Va in cerebellar plasticity and motor learning: a possible mechanism underlying neurological disorder in myosin Va disease." J Neurosci 31 (16): 6067-6078.
(2から4までは遺伝子改変マウスを用いて、この学習に必要な分子や神経回路を見出した論文)
5)岸本泰司 (2015). "瞬目反射条件づけ." 脳科学辞書 DOI:10.14931/bsd.6400 https://bsd.neuroinf.jp/wiki/瞬目反射条件づけ (瞬目反射条件づけについての詳しい解説)
■良く使用する材料・機器
1)蛍光顕微鏡システム ECLIPSE 90i (株式会社ニコンインステック)
2)電気生理実験装置MEG-2100(日本光電工業株式会社)
3)CMOSイメージセンサ (浜松ホトニクス株式会社)
 H27年度分野別専門委員
H27年度分野別専門委員
徳島文理大学・香川薬学部・薬学科
岸本泰司 (きしもとやすし)
https://kp.bunri-u.ac.jp/kph/index-7.html
「ミミズの神経系を利用して学習の仕掛けを明らかにする」
■背景 ヒトを含め動物は周囲の環境とのやり取りを履歴として残し、将来に出会う問題の解決を行っています。脳・神経系における記憶・学習はそのような意味で大変重要な役割を担っていますが、その仕掛けを解明するためには、簡単な体制の生き物が広く研究に使われています。われわれはミミズに古典的な条件付けを行い、その神経回路について、特に腹髄神経に注目して調べています。「パブロフの犬」の実験としても良く知られている、古典的条件付きの仕掛けを明らかにしようと目論んでいます。
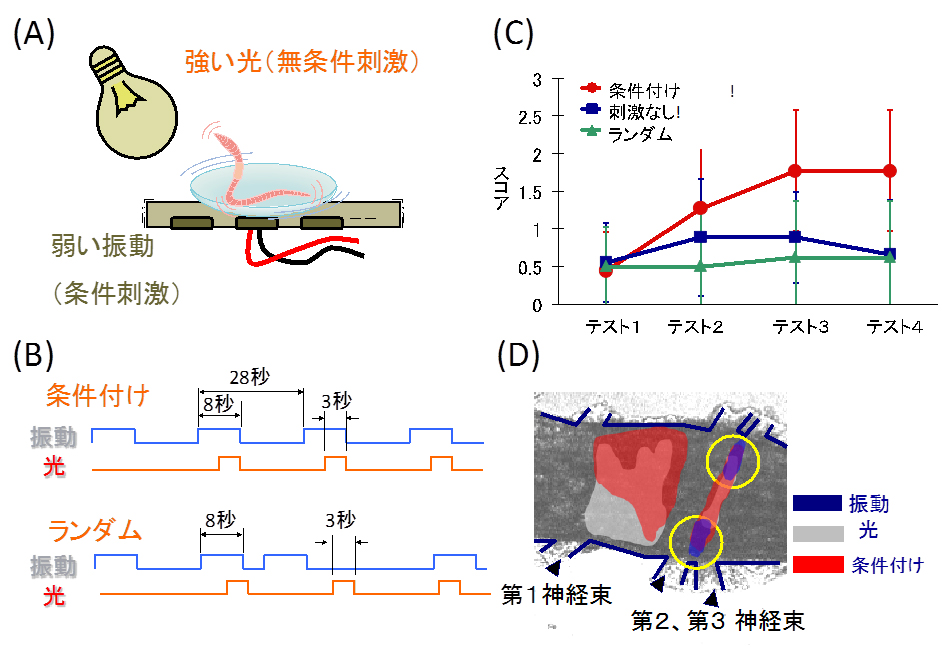
図1 ミミズの古典的条件付けに関する実験の概要
(A) ミミズに強い光(無条件刺激、無条件にミミズに逃避行動を行わせる刺激であるためにこのように呼びます)をあてると逃避運動を示します。また弱い振動(条件刺激、本来は逃避行動を引き起こさない刺激)は感じても身に危険を感じないので逃避反応は示しません。
(B) 条件付けを行う時には、8秒間続く弱い振動刺激の、最後の3秒間に強い光を振動と同時に与えます。ミミズに学習する能力があれば、「振動の後に嫌な光がくるから注意しよう。」と思うはずです(条件付け)。一方で同じ回数だけ振動と光の刺激を与えても、いい加減なタイミングや順序で刺激されると、ミミズは振動と光との関係を学ぶことができません(ランダム)。
(C) 振動と光の組み合わせを10回行うことを一セットとして、30回行いました。テスト1は条件付けを行う前、テスト2は1セット、テスト3は2セット、テスト4は3セットの条件付けのあとに、弱い振動刺激のみを与えたときに、どれくらいミミズが逃避行動を行うのかを調べました。縦軸のスコアは、3回弱い振動刺激を加えたときに、だいたい何回逃避行動を示すのかを示しています。正しい順序で条件付けを行うと、3セットの条件付けで条件付けできていることがわかりますが、ランダムに学習させた場合や、まったく条件付けを行わないと、振動で逃避行動を示すことはありません。
(D) 特殊な蛍光色素を使うと、神経活動を写真に撮ることができます。この図はミミズの腹側にある「腹髄神経節」をそのような蛍光色素で染色し、光、振動、条件付けの時に、どの場所の神経細胞が利用されているのかを示しています。光では多数の神経細胞が応答していることがわかります。また一方で振動の刺激に対しては、第2および第3神経束の根元の神経細胞が主に応答しています。神経が応答した領域を丁寧に調べると、図中の黄色の円で囲った領域が、特に古典的条件付けに関連したものと考えられます。
■研究概要 ミミズに弱い振動刺激と強い光刺激(光に対しては逃避行動を示すことが知られています)を繰り返し30回与えると、弱い振動刺激だけでも逃避行動を示すようになります(古典的条件付け)。この古典的条件付けには面白い性質があり、学習させた直後に4℃の部屋に10分程置いておくと、振動と光との関係を忘れてしまいます。また30回の繰り返し学習を行う場合、短い時間で急いで学習させると翌日には忘れてしまうのですが、ゆっくりと時間をかけて学習させると翌日にもちゃんと覚えています。「試験前の一夜漬け」が身につかないことは皆さんもよくご存知ですよね。古典的条件付けの神経回路や分子について調べるために、神経細胞の活動を、蛍光色素を使って見えるようにする実験(図1(D))や電極を神経細胞に刺して、神経興奮を直接調べる研究を進めています。
■科学的・社会的意義 本研究はミミズの神経系を利用して、記憶と学習の素過程を明らかにすることを目指したものです。神経細胞のレベルでみれば、ミミズとヒトも記憶と学習を同じような仕掛けによって行っています。そのため、例えば認知症に関わる創薬研究のモデル系としてミミズを利用することも可能です。ミミズの学習の研究が、アルツハイマー病やパーキンソン病などの治療薬の開発に利用できるかもしれません。
■参考文献
1)Watanabe H, Takaya T, Shimoi T, Ogawa H, Kitamura Y, Oka K. (2005) Influence of mRNA and protein synthesis inhibitors on the long-term memory acquisition of classically conditioned earthworms. Neurobiol Learn Mem.; 83(2): 151-7.(ミミズの古典的条件付けに関する論文)
2)北村美一郎、岡浩太郎 (2009) ミミズ、身近な動物を使った実験2(鈴木範男編)三共出版、p.65-82. (ミミズを使った古典的条件付けや逃避行動の実験手法についてまとめた実験書です)
3)Shimoi T, Mizutani K, Kojima D, Kitamura Y, Hotta K, Ogawa H, Oka K. (2014) Identification of oscillatory firing neurons associated with locomotion in the earthworm through synapse imaging. Neuroscience; 268:149-58. (神経細胞の活動を蛍光色素で調べる方法についての論文)
4)Mizutani K, Shimoi T, Kitamura Y, Ogawa H, Oka K. (2003) Identification of two types of synaptic activity in the earthworm nervous system during locomotion. Neuroscience;121(2): 473-8.
(ミミズが這う時に利用している神経細胞について蛍光色素を用いて調べた論文)
■良く使用する材料・機器
1) 高速共焦点レーザ顕微鏡システム(横河電機株式会社、株式会社ニコン)
2) 実験試薬 (和光純薬株式会社)
3) 冷却CCDカメラ ORCA-ER (浜松ホトニクス株式会社)
4) 電気生理実験装置(日本光電工業株式会社)
5) 電気生理実験用マニピュレータ他(株式会社ナリシゲ)
 H26年度分野別専門委員
H26年度分野別専門委員
慶應義塾大学理工学部生命情報学科
岡浩太郎 (おかこうたろう)
https://www.bpni.bio.keio.ac.jp
「分子の運動や反応を支配する一般法則」
■背景
体重の2%を占める脳は,感覚,思考,運動を司り,記憶・学習を担う,人間活動の基盤ともいえる器官です.われわれの脳は1000億個以上の神経細胞と,その10倍以上もの数のグリア細胞からできています.神経細胞は相互に連結し複雑な情報処理ネットワークを作り上げ,グリア細胞は神経細胞の生存をサポートしその働きを制御する役割を担っています(図1).
膨大な情報処理を行う脳は,よくコンピュータに例えられます.しかし,出荷されてからずっと同じ部品で働くコンピュータに対し,脳の部品,すなわち神経細胞やグリア細胞を構成する脂質やタンパク質(有機物ですので,金属のように長い間同じ性質を保つことができません)は一生を通じて常に入れ替わっているという点で,脳とコンピュータは大きく異なります.また,脳もコンピュータと同じく電気を情報伝達の信号の一つとして使いますが,電気信号を発生する仕組みも,伝達の方式も,コンピュータと比べてずっと複雑です. 常に部品が入れ替わっているなかで,どのように脳という構造が保たれ,記憶・学習・思考といった高次の機能を果たすことができるのか? 生物物理では,その根底に潜む物理法則や分子機構を明らかにすることを目指しています.ここでは,そんな生物物理的な脳研究の一つをご紹介します.
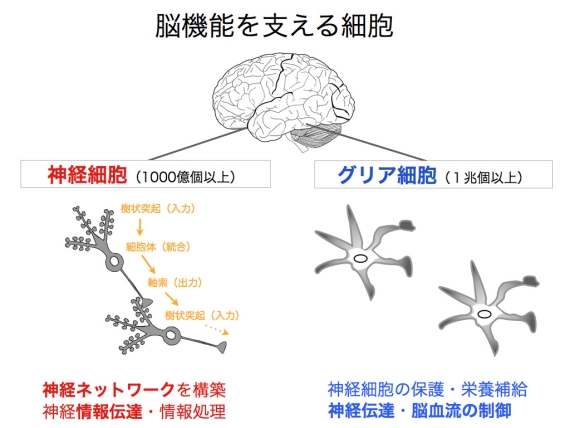
図1 脳を構成する細胞:脳は,神経ネットワークを構築する神経細胞(1000億以上)とその10倍以上もの数のグリア細胞から成る.
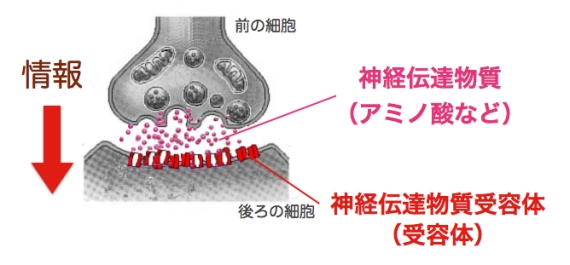
図2 シナプス:神経細胞同士の情報伝達にかかわる構造.情報を伝える細胞と伝えられる細胞の間には約20 nm のすき間がある.情報を伝える細胞はこのすき間に神経伝達物質を放出し,伝えられる細胞側の神経伝達物質受容体がそれを受けとることにより神経情報が伝わる.情報を受け取る細胞のシナプスの細胞膜には神経伝達物質が密集している.
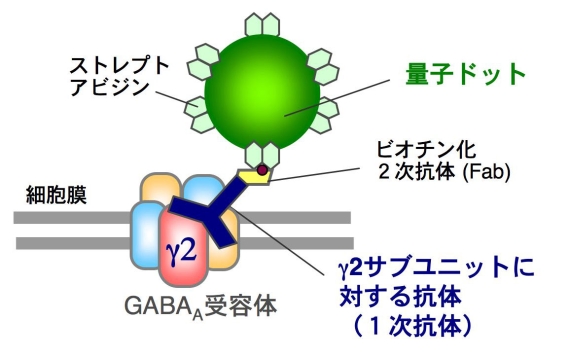
図3 量子ドットで細胞表面のGABAA受容体を1分子標識する方法.1次抗体,ビオチン化2次抗体を介して,ストレプトアビジン融合量子ドットで標識する.GABAA受容体は5つのサブユニットから構成されているが,その中で1つしか存在しないγ2 サブユニットに対する抗体を1次抗体として用いることで,受容体と量子ドットを1:1 で標識できる.量子ドットの動きは蛍光顕微鏡で追跡する.量子ドット1分子イメージング法では内在性分子の動きを観察できるという点で,外来性蛍光タンパク質を用いた従来の生細胞イメージング法に比べて優れている.
■研究概要 神経細胞と神経細胞は「シナプス」という特殊な構造(図2)を介して,情報を伝達します.このシナプスにおける情報伝達がいろいろな刺激によって強化されたり,弱まったりすることが,記憶・学習の基礎になっています.シナプスの情報伝達の強さが変化する仕組みを明らかにするために,我々は情報を前の細胞から受け取る役割のタンパク質「神経伝達物質受容体(図2,赤)の一種,GABAA受容体1分子を量子ドットという半導体ナノクリスタルで標識し(図3),その動きを顕微鏡で追跡しました(文献1).すると,シナプス伝達が弱くなる条件では,GABAA受容体の細胞膜上で動きが著しく増加していることが判明しました.一方,細胞膜上に存在する受容体の量は変わっていませんでした.すなわち,GABAA受容体が細胞内に取り込まれたり壊されたりするのではなく,細胞膜上でGABAA受容体の動きが増してシナプスから出て行きやすくなるため,結果的にシナプスの受容体の数が減りシナプス伝達が弱くなることがわかりました(文献2).この研究結果は,シナプス伝達効率を「細胞膜上での受容体の動き」という物理現象が決めていることを意味しています.
■科学的・社会的意義 シナプス伝達を制御する仕組みを知る研究は,記憶・学習・思考といった脳の活動の基本原理を明らかにするために,必要不可欠です.また,シナプス伝達の異常は,てんかん,統合失調症をはじめとする多くの脳神経疾患の原因となっています.シナプス伝達制御に関わっている分子の正体やその働きをさらに詳しく解明することで,さまざまな脳神経疾患に対する治療法の確立に貢献することが期待できます.
■参考文献
1. Bannai H, Levi S, Schweizer C, Dahan M, Triller A. “Imaging the lateral diffusion of membrane molecules with quantum dots.” Nature Protocols 1:2628-2634. (2006)
2. Bannai H, Levi S, Schweizer C, Inoue T, Launey T. Racine V, Sibarita J.B, Mikoshiba K, Triller A. ”Activity-dependent tuning of inhibitory neurotransmission based on GABAAR diffusion dynamics.”Neuron 62:670-682. (2009)
■良く使用する機器
1)倒立型リサーチ顕微鏡 (オリンパス株式会社)
2)EMCCDカメラ ImagEM (浜松ホトニクス株式会社)
3)共焦点レーザ走査型顕微鏡,多光子励起レーザ走査型顕微鏡(オリンパス株式会社)
4)共焦点レーザ走査型顕微鏡システム(株式会社ニコンインステック)
■良く使用する材料・機器
1)実験試薬 (和光純薬株式会社,他)
2)ラット海馬初代培養
3)マウススライス培養
 H24年度分野別専門委員
H24年度分野別専門委員
独立行政法人 理化学研究所 脳科学総合研究センター
坂内 博子 (ばんない ひろこ)
