NMR(溶液・タンパク質構造解析)
「溶液NMRの手法を用いて,生きた細胞の中の蛋白質の立体構造を決定する」
■背景
生きた細胞の中で,蛋白質がどのように働いているかを厳密に理解するためには,精製した試料について試験管内での立体構造とその変化や相互作用を解析するだけではなく,生きた細胞の中で「その場解析」をする必要があるのではないかという議論がされるようになってきていいます.核磁気共鳴(NMR)法は細胞に対するダメージが少なく,かつ原子分解能での解析が可能なことから,生細胞環境での詳細な解析に適しています(図1).私たちは,溶液中のNMRの手法を用いて,生きた大腸菌細胞の中の蛋白質の立体構造解析に世界で初めて成功しました(文献1,2).
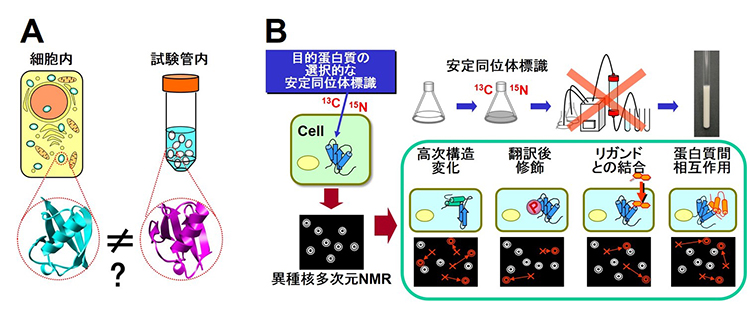
図1 A:細胞の中は様々な分子がひしめき合っており,試験管内の希薄な状態とは大きく異なると考えられている.蛋白質の立体構造やダイナミクス,相互作用も,細胞内と試験管内では異なる可能性がある.B:生きた細胞内の生体高分子を対象とした異種核多次元NMRをin-cell NMRと呼ぶ.In-cell NMRでは,細胞懸濁試料を直接NMR測定する.目的蛋白質のみを選択的にNMR測定可能な安定同位体で標識することができれば,細胞試料であってもその中の生体高分子の異種核多次元NMR測定が可能になる.細胞試料のスペクトルをモニターすることによって,細胞内の様々な生物学的に重要なイベントを「その場解析」することが可能になる.
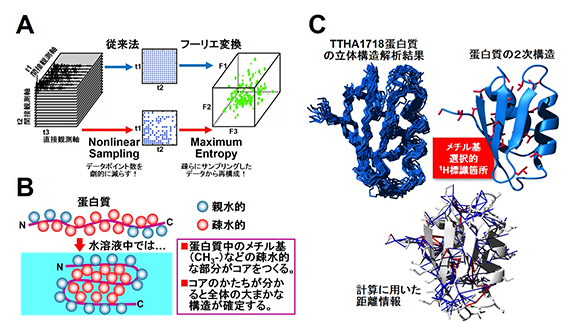
図2 A:従来法では半日~数日かかる3次元NMR測定を,データサンプリング法・スペクトルの再構成法を工夫することで,数時間で測定できるようにした.B:蛋白質の大まかな構造を規定する疎水的な部分のみを選択的に標識することで,複雑な解析を簡略化した.C:生きた大腸菌細胞中の高度好熱菌T. thermophilus HB8由来TTHA1718蛋白質の立体構造.選択的に標識した場所,立体構造計算に用いた距離情報も併せて示した.
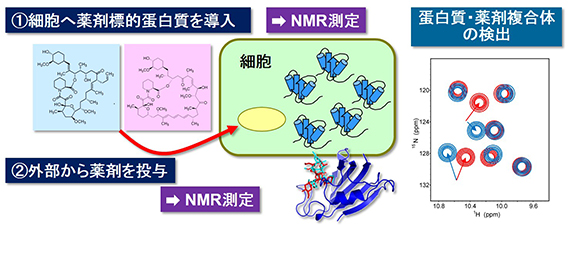
図3 In-cell NMR研究の創薬科学への応用例
■研究概要 大腸菌細胞中の高度好熱菌T. thermophiles HB8由来TTHA1718蛋白質の立体構造解析を試みました.NMRは感度の低い分光法であり,蛋白質の立体構造解析に必要な3次元NMRスペクトルを1種類測定するにも半日~数日の時間を要していましたが,測定におけるデータサンプリング法・スペクトルの再構成法を工夫することで,大腸菌細胞の生存時間(~6時間)内に3次元NMRスペクトルを測定することに成功しました(図2A).また,疎水的コアの形成に重要なメチル基のみに安定同位体標識を行うことで,細胞内蛋白質の立体構造情報を効率的に測定することにも成功しました(図2B).解析の結果,正確で高分解能な蛋白質の立体構造を算出することができました(図2C).
■科学的・社会的意義 本研究は,細胞内の込み合った環境が蛋白質の立体構造やダイナミクス,相互作用にどのような影響を与えるのかを解明するのに役立つと共に,例えば薬剤の候補の化合物と標的蛋白質の相互作用を細胞内で詳細に解析することによって,より望ましい性質を持った薬剤を選択したり,デザインしたりすることにも応用される事が期待されます(図3)。
■参考文献
1)Sakakibara, D., Sasaki, A., et al. (2009). "Protein structure determination in living cells by in-cell NMR spectroscopy." Nature 458(7234):102-105.
2)Ikeya, T., Sasaki, A., et al. (2010). "NMR protein structure determination in living E. coli cells using nonlinear sampling." Nat Protoc 5(6): 1051-1060.
■良く使用する材料・機器
1) 核磁気共鳴装置 AVANCE-III 600 (ブルカー・バイオスピン株式会社)
2) 安定同位体(2H,13C,15N)標識試薬 (大陽日酸株式会社)
3) CcpNmr Analysisソフトウエア (CCPN)
4) CYANAソフトウエア (株式会社エルエイシステムズ)
 H27年度分野別専門委員
H27年度分野別専門委員
首都大学東京 大学院理工学研究科
伊藤 隆 (いとうゆたか)
https://www.comp.tmu.ac.jp/osbc/Group_Ito/index.html
