赤外・ラマン
「振動を捉えて反応に迫る」
■背景
生命現象はタンパク質や核酸などの分子の働きによって支えられています。それらの分子は動き、かたちを変え、他の分子と反応しています。ここで分子を“多数の原子核がバネ(化学結合)で連結したもの”と考えて下さい(二重結合は一重結合よりも強いバネといった具合に)。実際に分子は絶えず振動しています。赤外分光法とラマン分光法は、振動状態の観測を通して、分子の構造や反応性を調べる実験手法であり、振動分光法と呼ばれています。振動分光法の実験では光を使います。分子に光を照射すると、光と分子の相互作用の結果、光の吸収や散乱が起こります(図1)。赤外分光法では赤外光を照射して、その光の吸収を解析します。一方、ラマン分光法では主に紫外光や可視光を照射して、散乱光を解析します。解析では、横軸に光の振動数(エネルギー)、縦軸に吸収強度や散乱強度をとった“スペクトル”を作ります(分光法では、光をエネルギー軸で分ける)。スペクトルには分子の振動状態が反映されています。私たちはタンパク質の複雑なスペクトルを読み解いて、タンパク質が働くしくみを研究しています。
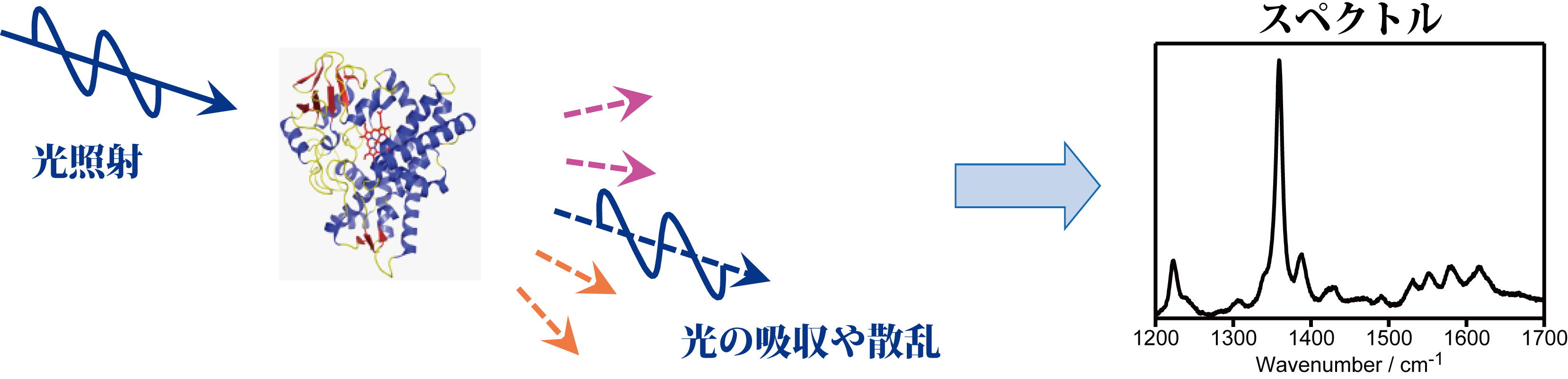
図1. 振動分光の実験
■研究概要 振動にも原子間の距離の伸縮や角度の振れなどいろいろな種類(モード)があります。もっともわかりやすい振動は、二原子分子の原子間伸縮振動でしょう。ここでは、一酸化窒素ガス(NO)を亜酸化窒素ガス(N2O)に変換するNO還元酵素(P450nor)をとりあげ、NOの原子間伸縮振動の解析例を紹介します。P450norは地球上の窒素循環を担うタンパク質であり、2分子のNOを取り込んでN2Oに変換します。このタンパク質は鉄原子を含み、鉄原子上で反応が起こります。私たちは1分子目のNOが鉄原子に結合した状態を赤外分光法で調べました(文献1)。鉄原子に結合したNOの伸縮振動の振動数は1853 cm-1(55.55×1012 Hz)でした。NOの伸縮振動数はNOの化学状態を反映します(2)。P450norに結合したNOは、鉄原子と殆ど電子の授受をしていない中性状態にあり、次の反応ステップに進むまで安定に保持されていることがわかりました。
■科学的・社会的意義 振動分光法には、タンパク質の反応過程をスペクトル変化を通して刻々と追跡する測定技術があり(時間分解振動分光法)、生物物理学の研究でよく使われています。近年、時間分解X線結晶構造解析(文献1)をはじめ、タンパク質の反応過程を観察する手法が大きく発展し、種々の手法を組み合わせた研究が増えています。振動分光法の持ち味は、タンパク質機能部位や反応化合物の化学構造、電子状態、プロトン化状態などを詳細に解析できるところです。他手法と組み合わせる中で、その持ち味を活かした解析が期待されます。
■参考文献
1)Tosha T., Nomura T., Nishida T., et al. (2017) "Capturing an initial intermediate during the P450nor enzymatic reaction using time-resolved XFEL crystallography and caged-substrate." Nat. Commun. 8: 1585.
2)NO+ 2300 cm-1(NO結合距離0.95 Å),NO▪ 1840 cm-1(NO結合距離1.15 Å),NO- 1290 cm-1(NO結合距離1.26 Å).cm-1は振動分光学で使われる振動数(厳密には波数)の単位.
■良く使用する材料・機器
1)レーザー(Coherent、Spectra-Physics)
2)分光器(HORIBA Jobin Yvon)
3)CCD(HORIBA Jobin Yvon、Princeton Instruments)
4)FTIR(Bruker)
5)光学部品(ソーラボジャパン)
6)除振台(ヘルツ、日本防振工業)
 H29年度分野別専門委員
H29年度分野別専門委員
理化学研究所・放射光科学総合研究センター
久保稔 (くぼみのる)
「タンパク質の構造・機能研究および高感度分析
のための新しい分子分光法の開発」
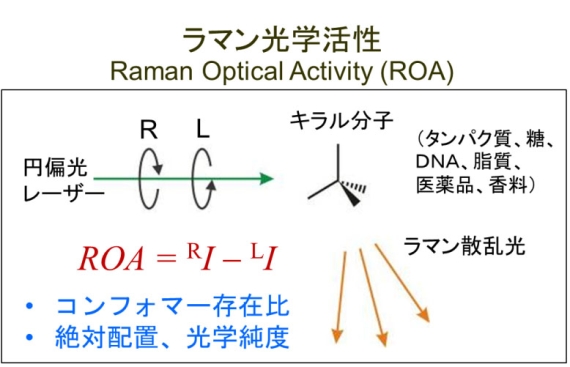
■背景 生体物質の構造や機能の研究あるいは高感度分析には新しい分子分光法の開発研究が欠かせない。当研究室の目的は、新しい分子分光法(特に振動分光法)の開発(表面増強ラマン散乱(Surface-enhanced Raman Scattering; SERS)、チップ増強ラマン散乱(Tip-enhanced Raman Scattering; TERS)、ラマン光学活性(Raman Optical Activity; ROA)など)、独創的な装置開発(SERS―プラズモン共鳴測定システム、高感度ROA分光器)さらにはスペクトル解析法の開発(量子化学計算、ケモメトリックス、二次元相関分光法など)が必要となる。当研究室ではハード、ソフトすべてについて研究し、総合的な立場から「タンパク質の構造・機能研究および高感度分析のための新しい分子分光法の開発」を行っている。
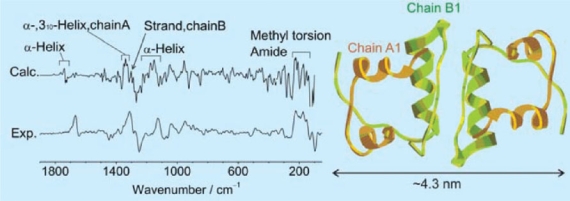
インシュリンのROAスペクトル(実験および計算)とそれから導いた二次構造
S. Yamamoto. et. al., Anal. Chem. 2012, 84, 2440-2451
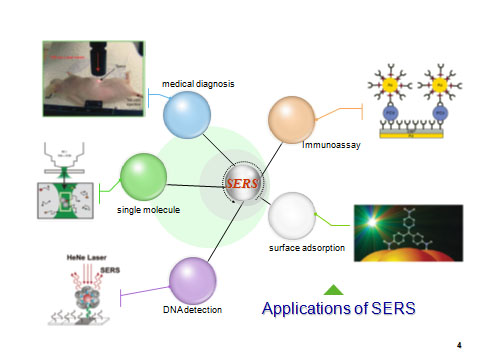
SERSの生命科学分野への応用
■研究概要 現在行っている研究は大きく分けてROA1)とSERS2-4)の二つに分けられる。1)ROA(図参照)分光法は分子の振動準位での光学活性を測定する分光法であり、キラルな分極率による信号を測定するため、通常の無偏光ラマン分光と比較して分子の立体構造により鋭敏である。また、速いラマン散乱現象に基づいているため、NMR分光法では信号が平均化されてしまうような、マイクロ秒以下の構造平衡にある分子の構造解析が可能である。2)SERSを用いると単分子のラマンスペクトル測定も可能となる。したがってSERSは最近生体物質の高感度分析法として非常に注目されている。図にあるようにSERSはDNA検出、イムノアッセイ、さらには病気の診断に応用される可能性がある。当研究室では最近、Avidinで誘起したSERS基板を用いたラベルフリー間接イムノアッセイ法を提案した。4)
■社会的意義
溶液中タンパク質構造に鋭敏でROA分光法を用いることで、既存の方法では分析できなかった、アルツハイマー病などの病気に深く関係するタンパク質アミロイド繊維や天然不定形タンパク質の詳細な分子構造とその変性メカニズムを初めて明らかにできる。
SERS法は生体物質の高感度分析法として極めて有望である。イムノアッセイや病気の診断にも使える可能性がある。さらにはSERSに基づくバイオセンサーも広く研究されている。
■参考文献
1) Yamamoto, S., Anal. Bioanal. Chem., 403, 2203, (2012).
2) Han, X., Zhao, B and Ozaki, Y., Anal. Bioanal. Chem., 394, 1719, (2009).
3) Han, X., Zhao, B and Ozaki, Y., Trends Anal. Chem., 38, 67, (2012).
4) Han, X., Chen, L., Ji, W., Xie, Y., Zhao, B., and Ozaki, Y., Small, 7, 316 (2012).
■良く使用する材料・機器
1)各種ラマン分光器(当研究室で開発したものおよび市販品)
顕微ラマン分光器、近接場ラマン-AFMシステム、表面増強ラマンープラズモン共鳴測定システム、ラマン光学活性分光器
2)FT-IR
3)各種近赤外分光器(当研究室で開発したものおよび市販品)
FT-NIR, 近赤外イメージングシステム、FT-NIR/IR, 可搬型近赤外イメージング装置
 H24年度分野別専門委員
H24年度分野別専門委員
関西学院大学・理工学部
尾崎幸洋 (おざきゆきひろ)
https://science.kwansei.ac.jp/~ozaki/index.html
