タンパク質結晶化法
「ハイドロゲルを用いた新規タンパク質結晶化法」
■背景
私たちの身体には10万種類以上のタンパク質が存在し活働しています。例えば、爪や髪の毛の主成分であるケラチン、皮膚や骨のコラーゲンなど多種多様なタンパク質が、私たちの生命を保ち続けるためにさまざまな活動をしています。例えば、元気な時にはタンパク質は正常に働いていますが、病気時には異常な働きをします。私たちが飲む薬は、この異常なタンパク質に結合し、その働きを抑えてくれます。その結果、病気を治すことができるのです。これは「鍵穴」と「鍵」の関係に例えることができます。タンパク質が「鍵穴」で、薬が「鍵」です。つまり、鍵穴にぴったり結合する鍵を作ることができれば、薬の開発へと繋がります。この鍵穴の形状を正確に細かく見るためには、タンパク質と薬とが結合した状態の構造を知ることが必要なのです。それを可能にするのが「タンパク質の結晶化」です。タンパク質分子を集めて結晶を作り、その結晶にX線を当てると、さまざまな計算を通してタンパク質の立体構造が分かります。しかし、タンパク質の結晶はお豆腐のように柔らかく、とても壊れやすいため、取り扱いがとても難しいのです。
新薬の開発では、新薬候補化合物と結合した複合体結晶を得るために、さまざまな化合物が溶けた溶液にタンパク質結晶を浸漬させる必要があります。しかし多くの化合物は高濃度の有機溶媒中に溶けています。結晶はそれらの溶液中に浸漬させると浸透圧ショックなどによって壊れてしまい、高品質な複合体結晶が得られないという問題がありました。
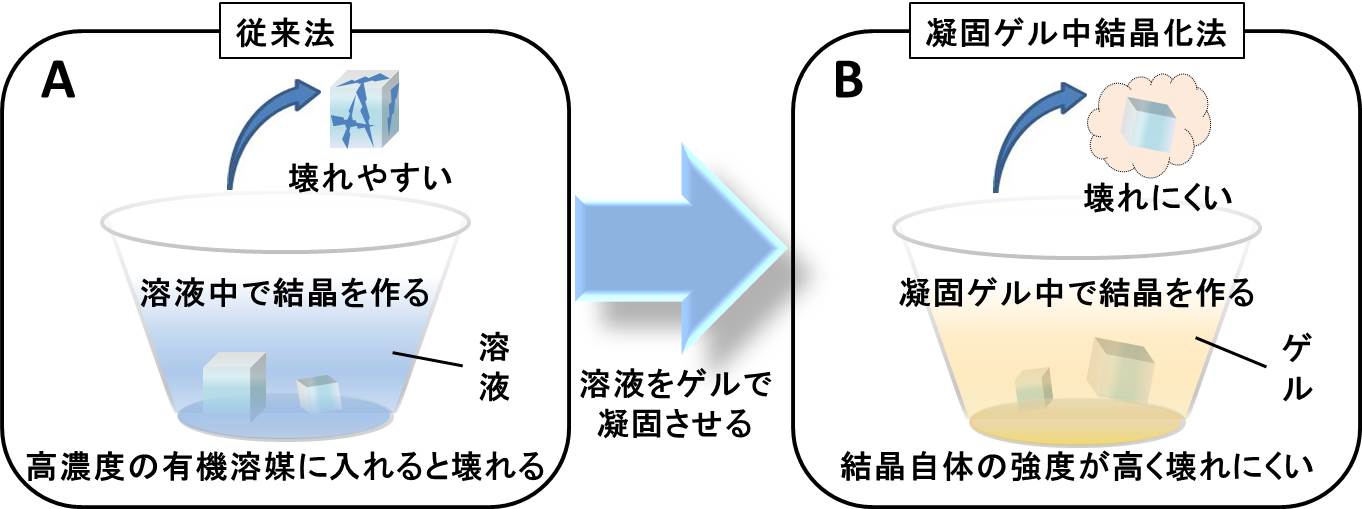
図1 従来の結晶化法と新しい凝固ゲル中で育成させる結晶化法の比較とそれぞれの特徴。
A: 溶液中で結晶を作る従来法。B: 凝固させたハイドロゲル中で結晶を作る方法
■研究概要 この問題を解決するために、凝固したゲル中(凝固ゲル中)でタンパク質結晶を成長させる全く新しい結晶化技術の開発を行いました(図1)。従来の結晶化は、溶液中で行われることが常識とされてきたため、ゼリーのように凝固したゲル中で結晶を成長させるという発想そのものがありませんでした。この技術によって育成した結晶は高濃度の有機溶媒や塩溶液中に浸漬しても、浸透圧ショックによる損傷を回避できることが分かりました。その結果、高濃度の有機溶媒に溶けた化合物溶液中に凝固ゲル中結晶を浸漬させることが可能となり、浸透圧ショックによる結晶の損傷を起こすことなく複合体結晶を作製することに成功しました。この複合体結晶を用いて立体構造解析を実施したところ、タンパク質に結合した化合物の様子をはっきりと観察することができました。
■科学的・社会的意義 この技術は、お豆腐のように壊れやすいタンパク質結晶の強度を上げることができました。これはこれまでの常識を覆す世界で初めての成果であり、これまで困難であった病気を引き起こす重要なタンパク質の立体構造解析を可能にするかもしれません。また、この技術で育成したタンパク質結晶は浸透圧ショックを回避できることから、高濃度の有機溶媒中に溶けたさまざまな新薬候補化合物とタンパク質との複合体結晶を容易に準備できる可能性を秘めています。そのため、複雑な「鍵穴」に合う「鍵」を膨大な新薬候補化合物から探し出す「創薬スクリーニング」への応用が期待されています。
■良く使用する材料・機器
1) 実体顕微鏡 SMZ1000 (株式会社ニコン)
2) pHメーター F-52 (堀場製作所)
株式会社堀場製作所
3) マイクロナイフ MK-100 (株式会社創晶)
 H26年度分野別専門委員
H26年度分野別専門委員
大阪大学・理学研究科
杉山 成 (すぎやま しげる)
https://www.dma.jim.osaka-u.ac.jp/view?l=ja&u=4492
「抗体を用いた創薬関連膜タンパク質のX線結晶構造解析」
■背景 膜タンパク質は、全タンパク質の30%を占め、細胞間情報伝達など重要な役割を果たしています。膜タンパク質の多くは創薬ターゲットでもあり、市販の医薬品の60%以上が膜タンパク質に作用することが知られています。膜タンパク質の立体構造はドラッグデザインなどの創薬に重要であり、産業界からも大きな期待がよせられています。しかし、膜タンパク質の詳細な結晶構造を明らかにするためには、①「対象の膜タンパク質を大量に精製すること」②「膜タンパク質の良質な結晶を作ること」が必要となるのですが、この2つが極めて難しく、現在でも350種類程度(ヒト由来は10種類程度)の構造が得られたにすぎません。今後、膜タンパク質の立体構造を体系的かつ網羅的に決定してゆくためには、下記の2点の技術開発が重要であると我々は考え研究を行っています。
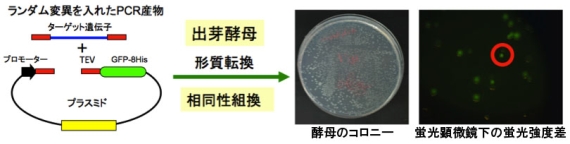
■研究概要 ①膜タンパク質の大量発現・精製システムの開発---構造解析には大量(mg以上)の精製標品が必要ですが、膜タンパク質の多くは各種発現系での発現量が低く、熱安定性も低いため大量調製が難しいことが深刻なボトルネックになっています。我々は、出芽酵母がもつ相同組換えとランダム変異導入等を用いた進化工学的アプローチを駆使して、熱安定化した高発現変異タンパク質の新規スクリーニング法の技術開発を行っています。
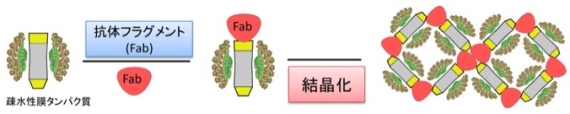
②膜タンパク質の結晶化法の開発---膜タンパク質を大量に精製することができても、結晶にならない場合が多くみられます。その原因として、「親水性表面が少ないため結晶化しづらい」、「コンフォメーション変化等の揺らぎがあるため結晶化しづらい」等があげられます。我々は、膜タンパク質と特異的に結合する抗体を用いて、膜タンパク質/抗体複 合体を形成させて親水性表面を拡張させ、揺らぎも同時に抑えることにより結晶性を向上させるという戦略が有効と考え、膜タンパク質に結合するモノクローナル抗体作製のための免疫法やスクリーニング法の開発および膜タンパク質との共結晶化法の開発を行っています。
■科学的・社会的意義 上記で開発した技術を駆使して、多くの創薬関連膜タンパク質の詳細構造が明らかになると期待しています。得られる構造には抗体医薬に繋がる抗体の構造も含まれ、関連する生命機能や疾患原因の理解から医薬品開発までのライフ・イノベーションの推進に大きく貢献できると考えています。
■参考文献 Hino T., Arakawa T., Iwanari T., Yurugi-Kobayashi T., Ikeda-Suno C., Nakada-Nakura Y., Kusano-Arai O., Weyand S., Shimamura T., Nomura N., Cameron A. D., Kobayashi T., Hamakubo T., Iwata S., Murata T. (2012) G-protein-coupled receptor inactivation by an allosteric inverse-agonist antibody. Nature 482: 237-240
■良く使用する材料・機器
1) 実体顕微鏡 SMZ1000 (株式会社ニコン)
2) pHメーター F-52 (株式会社堀場製作所)
3) マイクロナイフ MK-100 (株式会社創晶)
 H24年度分野別専門委員
H24年度分野別専門委員
千葉大学・理学研究科
村田武士 (むらたたけし)
https://murata-lab.matrix.jp
